云南省玉溪市2021-2022学年高二下学期教学质量检测化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 下列说法中错误的是( )A、硅酸钠水溶液可用作胶粘剂和木材防火剂 B、速滑馆使用CO2制冰,比用氟利昂制冰更环保 C、当镀锡铁制品的镀层破损时,镀层能对铁制品起保护作用 D、化石燃料和植物燃料燃烧时放出的能量最初来源于太阳能2. 高纯度的锗是一种半导体材料,如图是锗在元素周期表中的信息,下列说法正确的是( )
 A、价电子数为2 B、原子序数为32 C、原子的相对原子质量为72.61 D、位于ⅥA族,处于金属元素与非金属元素分界处3. “空气变面包,氨功不可没”。下列说法错误的是( )A、液氨可用作制冷剂 B、是平面三角形的极性分子 C、可以还原CuO D、合成氨是人工固氮最重要途径4. 下列操作规范且能达到实验目的的是( )
A、价电子数为2 B、原子序数为32 C、原子的相对原子质量为72.61 D、位于ⅥA族,处于金属元素与非金属元素分界处3. “空气变面包,氨功不可没”。下列说法错误的是( )A、液氨可用作制冷剂 B、是平面三角形的极性分子 C、可以还原CuO D、合成氨是人工固氮最重要途径4. 下列操作规范且能达到实验目的的是( )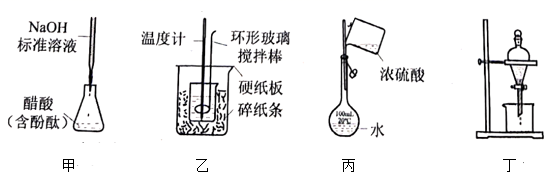 A、图甲测定醋酸浓度 B、图乙测定中和热 C、图丙稀释浓硫酸 D、图丁萃取分离碘水中的碘5. “青鸟不传云外信,丁香空结雨中愁。”文中所提丁香树富含如图的一种物质而芬芳。下列说法错误的是 ( )
A、图甲测定醋酸浓度 B、图乙测定中和热 C、图丙稀释浓硫酸 D、图丁萃取分离碘水中的碘5. “青鸟不传云外信,丁香空结雨中愁。”文中所提丁香树富含如图的一种物质而芬芳。下列说法错误的是 ( ) A、分子式为 B、该物质有4种官能团 C、该物质完全燃烧生成2种产物 D、1mol最多与反应6. 过氧化氢()被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法错误的是( )
A、分子式为 B、该物质有4种官能团 C、该物质完全燃烧生成2种产物 D、1mol最多与反应6. 过氧化氢()被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法错误的是( ) A、既有氧化性又有还原性 B、过氧化氢分子中含有H—H键、O—O键 C、过氧化氢分子的电子式为
A、既有氧化性又有还原性 B、过氧化氢分子中含有H—H键、O—O键 C、过氧化氢分子的电子式为 D、过氧化氢分子中存在极性共价键和非极性共价键
7. 下列“类比”结果正确的是( )A、单质的熔点 ,则单质的熔点Na<K B、 溶液显碱性,则 溶液显碱性 C、Na与水反应生成NaOH,则Fe与水蒸气反应生成 D、Fe与 溶液反应,则Fe与 溶液也能反应8. 下列离子方程式书写错误的是( )A、用硫化钠溶液除去废水中的: B、用饱和溶液处理锅炉水垢中的: C、酚酞滴入醋酸钠溶液中变为浅红色: D、和灭火器产生泡沫:9. 设为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,的分子数目为 B、所含的中子数为 C、中所含电子总数为 D、含的浓硫酸与足量的铜反应生成的分子的数目为10. 炼铁工业中高炉煤气的一种新的处理过程如图所示,有关该过程的叙述错误的是( )
D、过氧化氢分子中存在极性共价键和非极性共价键
7. 下列“类比”结果正确的是( )A、单质的熔点 ,则单质的熔点Na<K B、 溶液显碱性,则 溶液显碱性 C、Na与水反应生成NaOH,则Fe与水蒸气反应生成 D、Fe与 溶液反应,则Fe与 溶液也能反应8. 下列离子方程式书写错误的是( )A、用硫化钠溶液除去废水中的: B、用饱和溶液处理锅炉水垢中的: C、酚酞滴入醋酸钠溶液中变为浅红色: D、和灭火器产生泡沫:9. 设为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,的分子数目为 B、所含的中子数为 C、中所含电子总数为 D、含的浓硫酸与足量的铜反应生成的分子的数目为10. 炼铁工业中高炉煤气的一种新的处理过程如图所示,有关该过程的叙述错误的是( ) A、可减少的排放 B、Fe3O4和CaO均可循环利用 C、过程①和④的转化均为氧化还原反应 D、过程②中是反应物11. 下列实验方案能实现相应实验目的或得出相应结论的是( )
A、可减少的排放 B、Fe3O4和CaO均可循环利用 C、过程①和④的转化均为氧化还原反应 D、过程②中是反应物11. 下列实验方案能实现相应实验目的或得出相应结论的是( )选项
实验方案
实验目的或结论
A
向20%蔗糖溶液中加入少量稀H2SO4 , 加热;再加入银氨溶液,未出现银镜
蔗糖未水解
B
将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入溴水中,褪色
证明溴乙烷的消去反应有乙烯生成
C
向淀粉溶液中加入浓硝酸,加热,溶液没有变黄
证明淀粉溶液中无蛋白质
D
向混有苯酚的苯中加入适量的溴水充分反应后过滤弃去沉淀
除去苯中混有的苯酚
A、A B、B C、C D、D12. Ni可活化放出 , 其反应历程如图所示:
下列关于活化历程的说法错误的是( )
A、在此反应过程中Ni的成键数目发生变化 B、 C、活化能最大的步骤:中间体2→中间体3 D、只涉及C-H的断裂和生成13. 1,5-戊二胺( )是生物法制备尼龙材料的重要原料,利用双极膜(BPM)电渗析产碱技术可将生物发酵液中的1,5-戊二胺硫酸盐(含
)是生物法制备尼龙材料的重要原料,利用双极膜(BPM)电渗析产碱技术可将生物发酵液中的1,5-戊二胺硫酸盐(含 和SO)转换为1,5-戊二胺,实现无害化提取,工作原理如图所示。下列说法错误的是( )
和SO)转换为1,5-戊二胺,实现无害化提取,工作原理如图所示。下列说法错误的是( ) A、a极的电势比b极的低 B、m膜为阳离子交换膜,n膜为阴离子交换膜 C、电解过程中,H2SO4极室溶液的pH逐渐减小 D、b极区每生成11.2L气体(标准状况),理论上可生成2mol1,5-戊二胺14. 电导率是衡量电解质溶液导电能力大小的物理量。室温下,用的滴定10.00mL浓度均为的NaOH和的混合溶液,所得电导率曲线如图所示。已知 , , 下列说法错误的是( )
A、a极的电势比b极的低 B、m膜为阳离子交换膜,n膜为阴离子交换膜 C、电解过程中,H2SO4极室溶液的pH逐渐减小 D、b极区每生成11.2L气体(标准状况),理论上可生成2mol1,5-戊二胺14. 电导率是衡量电解质溶液导电能力大小的物理量。室温下,用的滴定10.00mL浓度均为的NaOH和的混合溶液,所得电导率曲线如图所示。已知 , , 下列说法错误的是( ) A、a点的混合溶液中:约为 B、b点的混合溶液中: C、c点的混合溶液中: D、a点→c点过程中,溶液中水的电离程度一直增大
A、a点的混合溶液中:约为 B、b点的混合溶液中: C、c点的混合溶液中: D、a点→c点过程中,溶液中水的电离程度一直增大二、非选择题
-
15. 完成下列问题:(1)、N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第周期第族。
②基态N原子核外电子排布式为;基态O原子核外有种运动状态的电子。
③基态S原子核外电子占据的最高能级的电子云轮廓图为形。
④Mg、Al两种元素中第一电离能较大的是(填元素符号),原因为。
(2)、几种元素的电负性数据如下表:O
F
Al
Br
……
3.5
4.0
1.5
2.8
……
①AlBr3的熔点AlF3的熔点(填“大于”、“小于”或“等于”),原因是。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为。
16. 硫代锑酸钠晶体(Na3SbS4·9H2O,M=481g/mol)为淡黄色晶体,不溶于乙醇、苯等有机溶剂,可溶于水,其水溶液呈强碱性,常用作生物碱试剂。实验室制备硫代锑酸钠的实验装置如图所示(夹持装置略去)。
实验步骤如下:
Ⅰ.按如图组装仪器,并将NaOH与NaSbO2的混合溶液加入仪器a中。
Ⅱ.将硅油加热至58℃并保持恒温,缓慢滴加双氧水并不断搅拌,反应30min,制备NaSb(OH)6。
Ⅲ.升高油浴温度至95~105℃,加热10min。
Ⅳ. 维持温度为95~105℃,滴加5.0mol/LNa2S溶液,搅拌3h。
Ⅴ. 趁热过滤,滤液经冷却结晶、过滤、洗涤、干燥后,得到硫代锑酸钠晶体。
回答下列问题:
(1)、仪器a的名称为;长导管的作用为。(2)、“步骤Ⅱ”中,将硅油加热至58℃采用的实验操作为;“步骤Ⅲ”的目的为。(3)、“步骤Ⅳ”的化学方程式为。(4)、“步骤Ⅴ”中,洗涤晶体所选用的最佳试剂为____(填选项字母)。A、蒸馏水 B、乙醇 C、苯 D、稀盐酸(5)、硫代锑酸钠晶体中常混有Na2S杂质,实验室可采用下列实验步骤测定其纯度:ⅰ.取4.81g硫代锑酸钠晶体与亚硫酸钠在沸水中发生反应);
ⅱ.用碳酸锌悬浊液除去硫化钠,反应一段时间后过滤;
ⅲ.向滤液中滴加3mL淀粉溶液,用c mol/L的碘标准溶液滴定()。
①“步骤ⅰ”中,达到滴定终点时的现象为。
②达到滴定终点时,消耗VmL碘标准溶液,则样品中硫代锑酸钠晶体的纯度为%(用含c、V的代数式表示)。
17. 钨酸()是一种重要的化工原料,用作催化剂,制造防火材料等。一种以黑钨矿(主要成分是FeWO4和MnWO4 , 还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如图所示。
已知:①“滤渣1”的成分是Mn3O4和Fe2O3。
②“水浸”后滤液中主要阴离子为、、、和。
③Ksp[Mg3(PO4)2]=1.0×10-24。
回答下列问题:
(1)、基态As原子中未成对的电子数为 , “滤渣2”的主要成分是。(2)、FeWO4发生“焙烧”时的化学反应方程式为。(3)、“除磷、砷”过程中P、As元素以Mg3(PO4)2和Mg3(AsO4)2形式沉淀,则“氧化”过程中加入溶液的目的是。(4)、当“滤液1”中c(Mg2+)=1×10-6mol/L时,此时是否沉淀完全。列式计算说明。(5)、“沉钨”后需要过滤、洗涤,则洗涤的具体操作为。18. 当今世界多国相继规划了碳达峰、碳中和的时间节点,中国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低。2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。因此,降低空气中二氧化碳含量成为研究热点,其中研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和解决能源问题的方案之一。I.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。

已知:CO2(g)+4H2(g)CH4(g)+2H2O(g)△H1=-205kJ·mol-1
反应II:CO(g)+3H2(g)CH4(g)+H2O(g)△H2=-246kJ·mol-1
(1)、则反应I的热化学方程式为。(2)、一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2 , 只发生上述反应I和反应II;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率v(H2)=反应II的平衡常数Kp=(用含字母P的代数式表示,已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替,某气体分压=气体总压强×该气体的物质的量分数)II.在催化剂作用下CO2加氢还可制得甲醇CO2(g)+3H2(g)CH3OH(g)+H2O(g)∆H=50kJ/mol。
(3)、能说明反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=50kJ/mol已达平衡状态的是____(填字母)。A、单位时间内生成1molCH3OH(g)的同时消耗了3molH2(g) B、在恒温恒容的容器中,混合气体的密度保持不变 C、在绝热恒容的容器中,反应的平衡常数不再变化 D、在恒温恒压的容器中,气体的平均摩尔质量不再变化(4)、III.CO2与H2催化重整制备CH3OCH3的过程中存在反应:①2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H<0;
②CO2(g)+H2(g)CO(g)+H2O(g)△H>0。
向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为;T2℃时主要发生反应。(填“①”或“②”),CO2平衡转化率随温度变化先降后升的原因为。
 19. 一种合成解热镇痛类药物布洛芬方法如下:
19. 一种合成解热镇痛类药物布洛芬方法如下:
已知:NaBH4是一种还原剂,完成下列填空:
(1)、C的分子式为 , B→C的反应类型是。(2)、D的结构简式是。(3)、E→F的化学方程式为。(4)、化合物M的分子式为C9H10O2 , 与布洛芬互为同系物,且有6个化学环境相同的氢原子,写出一种符合条件的M的结构简式。(5)、某同学查阅文献资料,发现C的另一种合成方法: +
+ 
 , 请评价该方法与上述流程中的合成方法相比,具有哪些优点。 (6)、参照上述合成路线,设计一条以1—丙醇主要原料合成(CH3)2CHCOCl的合成路线(其他无机试剂任选)。
, 请评价该方法与上述流程中的合成方法相比,具有哪些优点。 (6)、参照上述合成路线,设计一条以1—丙醇主要原料合成(CH3)2CHCOCl的合成路线(其他无机试剂任选)。