山东省日照市2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 中华传统文化博大精深,蕴含着丰富的化学知识。下列说法错误的是( )A、“凡弓弦取食柘叶蚕茧,其丝更坚韧”中“丝”的水解产物为氨基酸 B、“高奴县出脂水,燃之如麻,但烟甚浓”,所述“脂水”就是现在的地沟油 C、“南风大起,则一宵结成,名曰颗盐,即古志所谓大盐也”涉及蒸发结晶 D、“将生砒就置火上,以器覆之,令砒烟上飞着覆器”涉及的操作方法是升华2. 下列元素中,基态原子的价层电子排布式错误的是( )A、As 4s24p3 B、Cr 3d44s2 C、Ga 4s24p1 D、Ni 3d84s23. 下列实验操作正确的是( )A、萃取振荡时,分液漏斗下口应倾斜向下 B、蒸馏操作时,应先加热,再通冷凝水 C、将苯酚稀溶液滴加到溴水中,可用作苯酚的检验 D、用工业酒精制取无水乙醇,可直接蒸馏4. 一种抗血小板聚集的药物X的结构如图。下列关于X说法错误的是( )
 A、分子式为C19H20O6 B、分子中含有2个手性碳原子 C、1molX最多能与2molNaOH发生反应 D、1molX最多能与5molH2发生反应5. 下列实验仪器和操作正确的是( )
A、分子式为C19H20O6 B、分子中含有2个手性碳原子 C、1molX最多能与2molNaOH发生反应 D、1molX最多能与5molH2发生反应5. 下列实验仪器和操作正确的是( ) A、装置甲灼烧海带 B、装置乙除去CO2中的SO2 C、装置丙分离甘油和水 D、装置丁分离苯和溴苯6. 茉莉醛具有浓郁的茉莉花香,其结构简式如图,关于茉莉醛的说法正确的是( )
A、装置甲灼烧海带 B、装置乙除去CO2中的SO2 C、装置丙分离甘油和水 D、装置丁分离苯和溴苯6. 茉莉醛具有浓郁的茉莉花香,其结构简式如图,关于茉莉醛的说法正确的是( ) A、茉莉醛与苯甲醛互为同系物 B、1mol茉莉醛与足量银氨溶液反应,生成1mol银单质 C、茉莉醛使酸性高锰酸钾溶液褪色证明茉莉醛分子中含有碳碳双键 D、在一定条件下能与苯酚发生缩聚反应生成高分子化合物7. 下列说法正确的是( )A、甲酸的酸性比乙酸弱 B、[Cu(NH3)4]2+的空间构型为四面体结构 C、NaCl晶胞与CsCl晶胞中阳离子的配位数相同 D、金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子8. 硒(se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。一种含Se的新型AIE分子IV的合成路线如图:
A、茉莉醛与苯甲醛互为同系物 B、1mol茉莉醛与足量银氨溶液反应,生成1mol银单质 C、茉莉醛使酸性高锰酸钾溶液褪色证明茉莉醛分子中含有碳碳双键 D、在一定条件下能与苯酚发生缩聚反应生成高分子化合物7. 下列说法正确的是( )A、甲酸的酸性比乙酸弱 B、[Cu(NH3)4]2+的空间构型为四面体结构 C、NaCl晶胞与CsCl晶胞中阳离子的配位数相同 D、金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子8. 硒(se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。一种含Se的新型AIE分子IV的合成路线如图:
下列说法错误的是( )
A、II中所有原子可能共平面 B、III中只有N原子有孤电子对 C、III中N、O、S的电负性:O>N>S D、IV中S、Se原子均为sp3杂化9. 下列关于补铁剂中铁元素的价态探究实验说法正确的是( )A、可在中性条件下,用KSCN溶液检验补铁剂是否含有Fe3+ B、将补铁剂溶解在水中,加入KMnO4溶液,溶液褪色可证明补铁剂中含有Fe2+ C、将补铁剂溶解在浓盐酸中并稀释至pH=5,加入邻二氮菲,溶液变为橙红色可证明补铁剂中含有Fe2+ D、将补铁剂溶解在水中,加入K3[Fe(CN)6]生成蓝色沉淀,可证明补铁剂中含有Fe3+10. 铝离子电池常用离子液体AlCl3/[EMIM]Cl作电解质,其中阴离子有AlCl、Al2Cl , 阳离子为EMIM+( ),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是( ) A、EMIM+中存在大π键,表示为π B、Al2Cl中各原子最外层均达到8电子结构 C、1mol EMIM+中所含σ键17mol D、为使EMIM+获得良好的溶解性,不能将与N原子相连的-CH3、-C2H5替换为H原子11. 某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是( )
),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是( ) A、EMIM+中存在大π键,表示为π B、Al2Cl中各原子最外层均达到8电子结构 C、1mol EMIM+中所含σ键17mol D、为使EMIM+获得良好的溶解性,不能将与N原子相连的-CH3、-C2H5替换为H原子11. 某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是( )
气体
液体
固体
A
Cl2
FeCl2溶液
Cu
B
Br2
FeI2浓溶液
Fe
C
HCl
Na[Al(OH)4]溶液
Al(OH)3
D
NH3
H2O
Cu(OH)2
A、A B、B C、C D、D12. 某有机化合物结构如图,下列有关该有机物的说法正确的是( ) A、不饱和度为5 B、通过红外光谱可确定有机物中含有的官能团种类 C、与溴单质按照1:1发生加成反应最多得到2种产物 D、在浓硫酸加热的条件发生消去反应可能得到两种有机产物13. 储氢合金LaNi5、LaCo5、CeCo5等结构和CaCu5相同。CaCu5合金由图甲、乙两个原子层交替密堆积而成,丙是CaCu5的晶体结构。
A、不饱和度为5 B、通过红外光谱可确定有机物中含有的官能团种类 C、与溴单质按照1:1发生加成反应最多得到2种产物 D、在浓硫酸加热的条件发生消去反应可能得到两种有机产物13. 储氢合金LaNi5、LaCo5、CeCo5等结构和CaCu5相同。CaCu5合金由图甲、乙两个原子层交替密堆积而成,丙是CaCu5的晶体结构。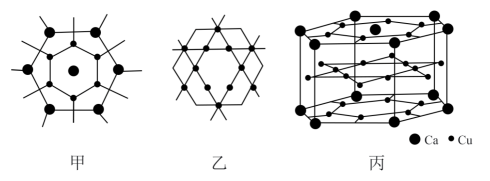
下列说法正确的是( )
A、CaCu5晶体类型为离子晶体 B、晶体中Ca原子与6个Cu原子配位 C、CaCu5晶体的一个晶胞中Cu原子数为15 D、LaNi5晶胞体积为9×10-23cm-3 , 储氢后形成LaNi5H4.5的合金,氢进入晶胞空隙,体积不变,氢在合金中的密度约为0.083g•cm-3二、多选题
-
14. 某镁铝尖晶石的晶胞由立方体M区和N区组成,结构如图。

下列说法正确的是( )
A、该晶胞的体积为×10-30cm3 B、与O2-最邻近的Al3+离子数为4 C、Mg2+和Mg2+之间的最短距离为pm D、该物质的化学式为MgAl2O415. 化学是以实验为基础的科学。下列实验操作正确且能达到目的的是( )选项
操作
目的
A
乙醇与浓硫酸加热至170℃,将产生的气体通入酸性高锰酸钾溶液
验证产物乙烯具有还原性
B
向粗盐水中依次加入过量的BaCl2、NaOH、Na2CO3溶液,静置过滤,最后向滤液中滴加盐酸至无气泡产生
精制食盐水
C
将醋酸与碳酸钠溶液反应后产生的气体通入苯酚钠溶液中
比较醋酸、碳酸、苯酚酸性
D
淀粉溶液中加入几滴稀硫酸,水浴加热,充分反应后加入NaOH溶液调节至碱性,再加入银氨溶液,水浴加热·
检验淀粉水解产物含有醛基
A、A B、B C、C D、D三、非选择题
-
16. 有机化工原料1,4-二苯基-1,3-丁二烯及某抗结肠炎药物有效成分的合成路线如图(部分反应略去试剂和条件):

已知:R-ClRMgCl
 (R、R′表示烃基)
(R、R′表示烃基)

回答下列问题:
(1)、有机化合物E的官能团名称是。(2)、F的化学名称为。(3)、H生成 的反应条件为。 (4)、A→B的化学方程式为。(5)、C→D反应类型为 , 该反应的目的是。(6)、符合下列条件的E的同分异构体有种(苯环上直接连甲基的不考虑),其核磁共振谱有四组峰,且峰面积之比为3:2:2:1的结构简式为(写出一种即可)。
的反应条件为。 (4)、A→B的化学方程式为。(5)、C→D反应类型为 , 该反应的目的是。(6)、符合下列条件的E的同分异构体有种(苯环上直接连甲基的不考虑),其核磁共振谱有四组峰,且峰面积之比为3:2:2:1的结构简式为(写出一种即可)。a.苯环上有2个取代基,无其它环状结构
b.能与NaHCO3溶液发生反应
c.能发生水解反应
17. H的同系物可用于合成心环烯,其合成路线如图:
已知:
①R-ClR-CN
②


③
 +
+


回答下列问题:
(1)、化合物E的结构简式为;化合物H中有两个五元环,其结构简式为。(2)、检验C中官能团的方法及现象。(3)、以上H的合成路线中未涉及到的反应类型是____。A、取代反应 B、加成反应 C、消去反应 D、氧化反应 E、还原反应(4)、A的二氯代物有种。(5)、根据上述信息,写出以环戊酮( )和3-氯己烷为原料制备
)和3-氯己烷为原料制备 的合成路线。 18. Si、Ti形成的单质及其化合物均有重要的科学研究价值,回答下列问题:(1)、硅(IV)酞菁二(三己基甲硅烷基氧化物)结构如图所示,基态Si原子的核外电子空间运动状态有种,组成元素中C、N、O、Si的第一电离能由大到小的顺序为 , 硅原子的杂化方式推断合理的是(填标号)。
的合成路线。 18. Si、Ti形成的单质及其化合物均有重要的科学研究价值,回答下列问题:(1)、硅(IV)酞菁二(三己基甲硅烷基氧化物)结构如图所示,基态Si原子的核外电子空间运动状态有种,组成元素中C、N、O、Si的第一电离能由大到小的顺序为 , 硅原子的杂化方式推断合理的是(填标号)。
A.sp2 B.sp3 C.sp3d D.sp3d2
(2)、二氧化钛是常用的具有较高催化活性和稳定性的光催化剂。TiO2可将CN-氧化成CNO- , 与CNO-互为等电子体的分子式为(写出一种即可)。(3)、卤化钠(NaX)和四卤化钛(TiX4)的熔点如图甲所示,TiX4熔点呈如图甲变化趋势的原因是。(4)、TiO2的一种晶型为金红石型,TiO2的晶胞结构如图乙所示,已知Ti4+与O2-之间的最近距离为dpm,晶胞参数α=β=γ=90°。O2-的配位数为 , 1号O的原子分数坐标为 , 晶胞密度为g•cm-3。 19. 肼(N2H4)又称联氨是一种重要的化工原料,易溶于水,具有强还原性;碱性条件下能与AgNO3溶液反应生成Ag和N2。回答下列问题:(1)、I.联氨制备(夹持及加热装置已省略):
19. 肼(N2H4)又称联氨是一种重要的化工原料,易溶于水,具有强还原性;碱性条件下能与AgNO3溶液反应生成Ag和N2。回答下列问题:(1)、I.联氨制备(夹持及加热装置已省略):①氯气和氨气在丙酮中生成丙酮联氮[(CH3)2C=NN=C(CH3)2]且有白烟生成。
②丙酮联氮水解可得到丙酮和水合肼(N2H4•H2O)。

按照接口顺序a→ → → → ←d进行实验 , 反应前先通入一段时间的氮气排出空气,丙酮中生成丙酮联氮的化学方程式为。
(2)、盛放丙酮溶液的仪器名称为 , 饱和食盐水中长颈漏斗的作用是;反应过程中要控制氯气的通入量不能过量的原因是。(3)、装置存在明显缺陷,g后所接装置图可以是(填标号)。 (4)、II.产品纯度测定:
(4)、II.产品纯度测定:量取水解液50.0mL加水调至弱碱性,配成250mL溶液,移出25.00mL,再加入足量AgNO3溶液;充分反应后,过滤、洗涤、干燥、称量,得固体质量为0.216g。则水解液中肼的含量为g•L-1。
20. 聚乙烯醇( )是重要的化工原料,常用于制造聚乙烯醇缩醛、耐汽油管道、粘合剂等。其制备的工业流程如图所示:
)是重要的化工原料,常用于制造聚乙烯醇缩醛、耐汽油管道、粘合剂等。其制备的工业流程如图所示:
已知:①电石气中通常含有H2S、PH3等杂质②电石气通入次氯酸钠溶液后反应后,溶液仍澄清③乙炔较易与羧酸反应生成酯
回答下列问题:
(1)、制取电石气时用饱和食盐水代替水的目的是 , 电石气通入NaClO溶液发生的主要反应的离子方程式为(写一个即可)。(2)、分离过程中采取的主要操作名称为。(3)、碱解时发生反应的化学方程式为 , 流程图中可循环利用的物质为。(4)、电石常用CaO与碳素材料在1800~2200℃的高温下制备,甲烷在高温下(1300~1500℃和氧不足的条件下燃烧时所放出的热量可使甲烷发生反应生成乙炔。与电石制乙炔相比,该方法的优点是(写一条即可),若标准状况下22.4m3甲烷可得到聚乙烯醇产品13.2kg,则甲烷的转化率为。