内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 北京冬奥会成功举办、“天宫课堂”如期开讲、神舟十三号顺利往返及“华龙一号”核电海外投产,均展示了我国科技发展的巨大成就。下列相关叙述正确的是( )A、冬奥会“雪花“形态主火炬台采用的双面屏,其将电能全部转化为光能 B、乙酸钠过饱和溶液析出晶体并放热的过程仅涉及化学变化 C、飞船返回舱表层材料中的玻璃纤维属于天然有机高分子材料 D、核电站反应堆所用铀棒中含有的和互为同位素
-
2. 为阿伏加德罗常数,下列说法正确的是( )A、 , 下,氢气中质子数目为 B、的溶液中,的数目为 C、电解精炼铜时,阳极减少 , 电路中转移的电子数目为 D、溶液中
-
3. 已知下列反应的热化学方程式:
则热分解反应的的为( )
A、 B、 C、 D、 -
4. 下列有关说法中正确的是( )A、溶液和溶液反应的中和热 , 则溶液和足量溶液反应的 B、常温下,均为9的醋酸钠和氢氧化钠溶液混合后改变 C、在反应中,若生成氯气,转移电子的数目为 D、为加强生态文明建设,我国大力发展核电、光电、风电、水电,电能属于一次能源
-
5. 是一种重要的化工原料,可发生如下转化。下列有关表述正确的是( )
 A、甲中含有离子键、极性共价键和氢键 B、戊与丁反应时,氧化剂与还原剂的物质的量之比为2∶1 C、浓硝酸见光易分解且易挥发,应用棕色试剂瓶盛放 D、向饱和溶液中依次通入过量的和 , 然后过滤可制得乙
A、甲中含有离子键、极性共价键和氢键 B、戊与丁反应时,氧化剂与还原剂的物质的量之比为2∶1 C、浓硝酸见光易分解且易挥发,应用棕色试剂瓶盛放 D、向饱和溶液中依次通入过量的和 , 然后过滤可制得乙 -
6. 酸碱中和滴定实验中,下列说法正确的是( )A、中和滴定操作中所需标准溶液越浓越好,指示剂一般加入 B、滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 C、酸碱指示剂的变色点就是反应终点 D、滴定前滴定管中的液体液面处于处,滴定过程中用去的液体,此时滴定管中剩余液体的体积为
-
7. 下列事实中,不能用勒夏特列原理解释的是( )A、开启啤酒瓶后,瓶中立刻泛起大量泡沫 B、在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化 C、实验室中常用排饱和食盐水的方法收集Cl2 D、工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
-
8. 下列事实可证明醋酸是弱酸的是( )A、醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 B、等体积等的盐酸和醋酸,稀释相同倍数后与等量且足量的锌反应,两者反应速率相同,但醋酸产生氢气多 C、完全中和醋酸溶液需要溶液 D、醋酸溶液的
-
9. 实验室进行粗盐提纯时,需除去 和 ,所用试剂包括 以及( )A、 B、 C、 D、
-
10. 下列五种混合溶液,由分别为的两种溶液等体积混合而成:
①与 ②与
③与 ④与
⑤与 , 由大到小排序正确的是( )
A、①>④>③>②>⑤ B、①>③>⑤>④>② C、②>④>③>⑤>① D、②>③>④>⑤>① -
11. 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到平衡: K=0.1。反应前CO的物质的量为10mol,平衡后CO的物质的量为8mol。下列说法正确的是( )A、升高温度,H2S浓度增大,表明该反应是吸热反应 B、通入CO后,正反应速率逐渐增大 C、反应前H2S的物质的量为6mol D、CO的平衡转化率为20%
-
12. 根据实验目的,下列实验及现象、结论都正确的是( )
选项
实验目的
实验及现象
结论
A
向溶液中滴加过量氯水,再加入淀粉溶液
先变橙色,后变蓝色
氧化性:
B
检验铁锈中是否含有二价铁
将铁锈溶于浓盐酸,滴入溶液,紫色褪去
铁锈中含有二价铁
C
探究氢离子浓度对、相互转化的影响
向溶液中缓慢滴加硫酸溶液,黄色变为橙红色
增大氢离子浓度,转化平衡向生成的方向移动
D
检验乙醇中是否含有水
向乙醇中加入一小粒金属钠,产生无色气体
乙醇中含有水
A、A B、B C、C D、D -
13. 在PdCl2-CuCl2做催化剂和适宜的温度条件下,用O2将HCl氧化为Cl2:4HCl(g)+O2(g)=2H2O(g)+2Cl2(g) ΔH<0,下列有关说法错误的是( )A、降低温度,可提高Cl2产率 B、提高 , 该反应的平衡常数增大 C、若断开1molH-Cl键的阿时有1molH-O键断开,则表明该反应达到平衡状态 D、该反应的平衡常数表达式
-
14. 关于化学平衡常数K,电离平衡常数或 , 水解平衡常数 , 沉淀溶解平衡常数 , 水的离子积常数的叙述中错误的是( )A、K、或都与温度有关,温度越高,常数值越大 B、二元弱酸如的电离常数 C、由 , 说明相同物质的量浓度时,次氯酸的酸性比醋酸弱 D、因为 , 则反应能发生
-
15. 时,下列说法正确的是( )A、的某酸溶液中一定存在: B、的氨水溶液稀释10倍后 C、相同的溶液、溶液、溶液,其浓度大小关系: D、常温下,溶液中,由水电离产生的浓度为
-
16. 时,向密闭容器中充入和发生反应:。部分物质的物质的量随时间t变化如图实线所示。下列说法正确的是( )
 A、该反应的平衡常数 B、时, C、曲线a代表随时间变化的曲线 D、若该反应在时进行,则虚线b可表示的变化
A、该反应的平衡常数 B、时, C、曲线a代表随时间变化的曲线 D、若该反应在时进行,则虚线b可表示的变化 -
17. 下列说法正确的是( )A、原子半径:P<S<Cl B、电负性:C<N<O C、热稳定性:HF<HCl<HBr D、第一电离能:Na<Mg<Al
-
18. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )A、S和Si B、CCl4和KCl C、NaCl和HCl D、CO2和H2O
-
19. 下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A、沸点: B、分子是非极性分子 C、C形成的单质中键与键个数之比为1∶2 D、B,C,D形成的简单气态氢化物互为等电子体 -
20. 下列图示或化学用语表示错误的是( )




A.的空间结构模型
B.的模型
C.基态的价层电子的轨道表示式
D.轨道的电子云轮廓图
A、A B、B C、C D、D -
21. 锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )
 A、S和分别位于元素周期表的p区和d区 B、该晶胞中和数目均为4。 C、位于构成的四面体空隙中 D、氧化锌的熔点低于硫化锌
A、S和分别位于元素周期表的p区和d区 B、该晶胞中和数目均为4。 C、位于构成的四面体空隙中 D、氧化锌的熔点低于硫化锌 -
22. “春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句。下列关于该诗句的说法错误的是( )A、古代的蜡是高级脂肪酸酯,属于高分子聚合物 B、蚕丝属于天然高分子材料 C、蚕丝的主要成分是蛋白质 D、“蜡炬成灰”过程发生了氧化反应
-
23. 紫花前胡醇
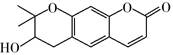 可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( ) A、分子式为C14H14O4 B、不能使酸性重铬酸钾溶液变色 C、能够发生水解反应 D、能够发生消去反应生成双键
可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( ) A、分子式为C14H14O4 B、不能使酸性重铬酸钾溶液变色 C、能够发生水解反应 D、能够发生消去反应生成双键 -
24. 下列表述正确的是( )A、苯和氯气生成的反应是取代反应 B、蔗糖、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 C、
 至少有12个原子共平面
D、硫酸作催化剂,水解所得乙醇分子中有
至少有12个原子共平面
D、硫酸作催化剂,水解所得乙醇分子中有
-
25. 分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构) ( )A、3种 B、4种 C、5种 D、6种
-
26. 2021年诺贝尔化学奖颁给了“在不对称催化方面”做出贡献的两位科学家。脯氨酸(结构如图)可参与诱导不对称催化反应。下列关于脯氨酸的说法正确的是( )
 A、可发生取代、不可发生氧化反应 B、饱和碳原子上的二氯代物有10种 C、由于有羧基不能形成分子间氢键 D、与
A、可发生取代、不可发生氧化反应 B、饱和碳原子上的二氯代物有10种 C、由于有羧基不能形成分子间氢键 D、与 互为同分异构体
互为同分异构体
二、综合题
-
27. 填写下列空白(1)、时,将的氨水与的盐酸等体积混合所得溶液中 , 则溶液显(填“酸”“碱”或“中”)性。(2)、净水的原理是(用离子方程式表示)。(3)、常温下,某水溶液M中存在的离子有: , 存在的分子有。根据题意回答下列问题:
①的水溶液呈性﹐主要原因是(用离子方程式表示): , 往溶液中加入上可抑制其水解(填字母标号)
A.固体 B.氯化铁固体 C.水 D.碳酸钠固体
②已知 , 往溶液中加入溶液,混合后溶液中的浓度为。(忽略的水解)
-
28. 铁及其化合物在生产和生活中具有广泛的用途。请回答下列问题。(1)、铁制品暴露在潮湿空气中容易发生腐蚀,通过图甲所示装置可验证铁钉是否发生电化学腐蚀,正极反应式是。
 (2)、利用图乙装置可模拟工业生产高铁酸盐,阳极反应为 , 阴极区的溶液(填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为 , 充电时阳极反应为 , 放电时每转移电子,正极有被还原。
(2)、利用图乙装置可模拟工业生产高铁酸盐,阳极反应为 , 阴极区的溶液(填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为 , 充电时阳极反应为 , 放电时每转移电子,正极有被还原。 -
29. 环戊二烯(
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题: (1)、已知:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题: (1)、已知: (g) =
(g) =  (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:  (g)+ I2(g) =
(g)+ I2(g) =  (g)+2HI(g) ③ ΔH3=kJ·mol −1。 (2)、某温度下,等物质的量的碘和环戊烯(
(g)+2HI(g) ③ ΔH3=kJ·mol −1。 (2)、某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为 , 该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为 , 该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。 A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)、环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。 A、T1>T2 B、a点的反应速率小于c点的反应速率 C、a点的正反应速率大于b点的逆反应速率 D、b点时二聚体的浓度为0.45 mol·L−1
A、T1>T2 B、a点的反应速率小于c点的反应速率 C、a点的正反应速率大于b点的逆反应速率 D、b点时二聚体的浓度为0.45 mol·L−1 -
30. 回答下列问题:(1)、X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法错误的是A、若W是单质铁,则Z溶液可能是溶液 B、若W是氢氧化钠,则X水溶液呈酸性 C、若W是氧气,则X、Z的相对分子质量可能相差48 D、若W是强氧化性的单质,则X可能是金属铝(2)、A是一种常见的铵盐,受热分解可得到碱性气体B,C、D是常见的两种氧化物,E溶液显酸性。A、B、C、D、E是含有一种相同元素的五种化合物,在一定条件下可发生如图所示的转化。
①B的化学式;D的颜色。
②实验室中常用A和另一种固体制备B,写出相应的化学方程式。
(3)、电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。①图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母标号)。
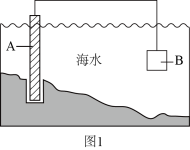
a.碳棒 b.锌板 c.铜板
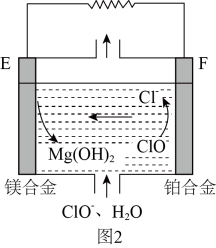
②镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的(填“正”或“负”)极。F电极上的电极反应式为。
-
31. 元素周期表中第四周期元素形成的化合物性质丰富,回答下列问题:(1)、复兴号高铁车体材质用到、等元素。的一种配合物化学式为 , 下列说法正确的是____(填字母标号)。A、与原子配位时,提供孤电子对的是C原子 B、原子的配位数为6 C、中C原子的杂化类型为 D、中键与键数目之比为5∶2(2)、能形成化合物 , 在该化合物中不含____(填字母标号)。A、键 B、键 C、配位键 D、离子键 E、极性键 F、非极性键(3)、中的键角比的键角(填“大”或“小”)原因是。(4)、在催化作用下,呋喃(
 )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( )。二者熔、沸点关系为:呋喃吡咯(填“高于”或“低于”),原因是。 (5)、的晶胞结构如图甲所示,其中离子坐标参数A为 , B为 , 则C的离子坐标参数为。一定温度下,晶体可以自发地分散并形成“单分子层”,可以认为作密置单层排列,填充其中(如图乙),已知的半径为 , 设阿伏加德罗常数值为 , 每平方米面积上具有该晶体的质量为g(用含a、的代数式表示)。
)。二者熔、沸点关系为:呋喃吡咯(填“高于”或“低于”),原因是。 (5)、的晶胞结构如图甲所示,其中离子坐标参数A为 , B为 , 则C的离子坐标参数为。一定温度下,晶体可以自发地分散并形成“单分子层”,可以认为作密置单层排列,填充其中(如图乙),已知的半径为 , 设阿伏加德罗常数值为 , 每平方米面积上具有该晶体的质量为g(用含a、的代数式表示)。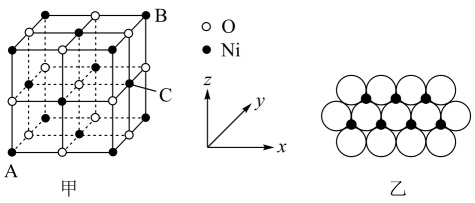
-
32. 化合物M(
 )是合成药物的中间体,实验室合成M的一种路线如图:
)是合成药物的中间体,实验室合成M的一种路线如图:
已知:①A的核磁共振氢谱中有3组吸收峰
②
 +HCl
+HCl ③
回答下列问题:
(1)、A的化学名称为。(2)、B的结构简式为;D中官能团的名称为。(3)、由C和E生成F的化学反应中加入的作用为。(4)、G与M中手性碳(连有四个不同原子或基团的碳)的数目之比为。(5)、同时满足下列条件的H的同分异构体有种。①能与溶液发生显色反应 ②能发生水解反应 ③苯环上连有6个取代基
(6)、参照上述合成路线和信息,以氯苯和乙烯为原料(无机试剂任选),设计制备 的合成路线。
的合成路线。
