江西省宜春市2021-2022学年高二下学期期末质量检测化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 化学与生产、生活密切相关,下列说法错误的是( )A、“新冠”疫苗需冷藏储运,这与蛋白质变性有关 B、制作北京冬奥会吉祥物“冰墩墩”使用的聚碳酸酯属于环保型高分子材料 C、“天宫一号”使用的碳纤维,是一种新型的有机高分子材料 D、使用没食子酸(
 )和铁盐可以制造墨水
2. 下列物质不属于高分子化合物的是( )A、淀粉 B、油脂 C、蛋白质 D、纤维素3. 化学学科需要借助化学语言来描述,下列化学用语正确的是( )A、乙烯的空间充填模型:
)和铁盐可以制造墨水
2. 下列物质不属于高分子化合物的是( )A、淀粉 B、油脂 C、蛋白质 D、纤维素3. 化学学科需要借助化学语言来描述,下列化学用语正确的是( )A、乙烯的空间充填模型: B、羟基的电子式:
B、羟基的电子式: C、丁烯的键线式:
C、丁烯的键线式: D、乙醛的结构简式
4. 下列有机物命名正确的是( )A、
D、乙醛的结构简式
4. 下列有机物命名正确的是( )A、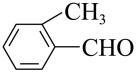 甲基苯甲醛
B、
甲基苯甲醛
B、 2,二甲基戊炔
C、
2,二甲基戊炔
C、 异丁酸甲酯
D、
异丁酸甲酯
D、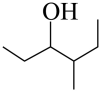 4,二甲基戊醇
5. 下列分子式只代表一种物质的是( )A、 B、 C、 D、6. 相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )A、和 B、和 C、和 D、和7. 用水即可区别的一组物质是( )A、己烯、苯、溴乙烷 B、乙酸乙酯、花生油、淀粉 C、乙醇、硝基苯、葡萄糖溶液 D、苯、乙酸、四氯化碳8. 为阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,的乙醇溶液中,含键的数目为 B、标准状况下,中所含氯原子数为 C、乙酸与尿素组成的混合物中含有氢原子总数为 D、与足量酸性高锰酸钾溶液反应时转移电子数为9. 提纯下列物质(括号内为少量杂质),能达到目的的是( )
4,二甲基戊醇
5. 下列分子式只代表一种物质的是( )A、 B、 C、 D、6. 相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )A、和 B、和 C、和 D、和7. 用水即可区别的一组物质是( )A、己烯、苯、溴乙烷 B、乙酸乙酯、花生油、淀粉 C、乙醇、硝基苯、葡萄糖溶液 D、苯、乙酸、四氯化碳8. 为阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,的乙醇溶液中,含键的数目为 B、标准状况下,中所含氯原子数为 C、乙酸与尿素组成的混合物中含有氢原子总数为 D、与足量酸性高锰酸钾溶液反应时转移电子数为9. 提纯下列物质(括号内为少量杂质),能达到目的的是( )选项
混合物
除杂试剂
分离方法
A
溴乙烷(乙醇)
生石灰
蒸馏
B
苯(苯酚
浓溴水
过滤
C
溴苯(溴)
溶液
分液
D
苯(硝基苯)
蒸馏水
分液
A、A B、B C、C D、D10. 某物质的分子式为 , 取该物质在足量的中充分燃烧后,将产物全部通入过量的中,若固体的质量增加了 , 且 , 则该物质是( )A、 B、 C、 D、11. 将某试剂分别加入到烧杯①、②中,下列“试剂”和“烧杯中的物质”不能完成“实验目的”的是( )
选项
实验目的
试剂
烧杯中的物质
A
水分子中的氢原子活泼性强于乙醇羟基中的氢原子
金属钠
①水②乙醇
B
羟基对苯环的活性有影响
饱和溴水
①苯②苯酚溶液
C
甲基对苯环的活性有影响
酸性高锰酸钾溶液
①甲基环己烷②甲苯
D
苯酚的酸性弱于醋酸
碳酸氢钠溶液
①醋酸②苯酚溶液
A、A B、B C、C D、D12. 亮菌甲素是黄色或橙黄色结晶粉末,几乎不溶于水。其结构简式如图所示,下列有关亮菌甲素的叙述正确的是( ) A、亮菌甲素的分子式为 B、亮菌甲素与足量溴水反应,消耗溴水的量为 C、亮菌甲素与足量发生加成反应后,分子中官能团的个数增加 D、亮菌甲素与足量发生加成反应后,分子中含有6个手性碳原子13. 已知某有机化合物结构如图所示,下列说法正确的是( )
A、亮菌甲素的分子式为 B、亮菌甲素与足量溴水反应,消耗溴水的量为 C、亮菌甲素与足量发生加成反应后,分子中官能团的个数增加 D、亮菌甲素与足量发生加成反应后,分子中含有6个手性碳原子13. 已知某有机化合物结构如图所示,下列说法正确的是( ) A、分子中所有C原子可能共平面 B、该物质发生苯环上的一氯取代可生成7种产物 C、该有机物核磁共振氢谱有7组吸收峰,峰面积比为1∶2∶2∶2∶4∶4∶3 D、该物质不能被酸性高锰酸钾溶液氧化14. 分子式为的有机物R在酸性条件下可水解为酸和醇,下列说法错误的是( )A、这些醇和酸重新组合可形成的酯共有12种 B、R的同分异构体有4种 C、R水解得到的酸至少有5对共用电子对 D、R水解得到的醇发生消去反应,可得到4种烯烃15. 环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。下列说法正确的是( )
A、分子中所有C原子可能共平面 B、该物质发生苯环上的一氯取代可生成7种产物 C、该有机物核磁共振氢谱有7组吸收峰,峰面积比为1∶2∶2∶2∶4∶4∶3 D、该物质不能被酸性高锰酸钾溶液氧化14. 分子式为的有机物R在酸性条件下可水解为酸和醇,下列说法错误的是( )A、这些醇和酸重新组合可形成的酯共有12种 B、R的同分异构体有4种 C、R水解得到的酸至少有5对共用电子对 D、R水解得到的醇发生消去反应,可得到4种烯烃15. 环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。下列说法正确的是( ) A、是反应物之一 B、该反应的总反应属于取代反应 C、该反应过程中有3种中间体 D、反应过程存在极性键和非极性键的断裂和形成16. 某高分子材料的结构为
A、是反应物之一 B、该反应的总反应属于取代反应 C、该反应过程中有3种中间体 D、反应过程存在极性键和非极性键的断裂和形成16. 某高分子材料的结构为 。下列有关该高分子材料的说法正确的是( ) A、该高分子材料由两种单体通过加聚反应制得 B、该高分子材料及形成它的单体不全能使溴水褪色 C、合成该高分子材料的单体之间存在同系物 D、
。下列有关该高分子材料的说法正确的是( ) A、该高分子材料由两种单体通过加聚反应制得 B、该高分子材料及形成它的单体不全能使溴水褪色 C、合成该高分子材料的单体之间存在同系物 D、 是合成该高分子材料的单体
是合成该高分子材料的单体
二、非选择题
-
17. 回答下列问题:(1)、相对分子质量为114且一氯代物只有一种的烷烃,其结构简式为。(2)、某物质的最简式为CH,属于芳香烃,且所有原子一定在一个平面上,写出该物质与浓硝酸、浓硫酸混合加热的化学方程式:。(3)、已知
 是由某单烯烃与HCl加成而获得,该单烯烃中无顺反异构的同分异构体的结构简式为。 (4)、某有机物的结构如图所示:
是由某单烯烃与HCl加成而获得,该单烯烃中无顺反异构的同分异构体的结构简式为。 (4)、某有机物的结构如图所示: ;它的同分异构体中属于芳香族化合物的醛和酮的有种。 (5)、水杨酸(
;它的同分异构体中属于芳香族化合物的醛和酮的有种。 (5)、水杨酸( )与足量溶液发生反应的化学方程式为。 18. 为测定有机化合物A的分子结构,进行实验:(1)、将有机物A置于氧气流中充分燃烧,实验测得生成和 , 消耗氧气。标准状况下)。则该物质中各元素的原子个数比。(2)、现用下列方法测定该有机化合物的相对分子质量和分子结构。
)与足量溶液发生反应的化学方程式为。 18. 为测定有机化合物A的分子结构,进行实验:(1)、将有机物A置于氧气流中充分燃烧,实验测得生成和 , 消耗氧气。标准状况下)。则该物质中各元素的原子个数比。(2)、现用下列方法测定该有机化合物的相对分子质量和分子结构。方法一:用质谱法分析得知A的相对分子质量为150。可推知化合物A的分子式为。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为2∶2∶2∶1∶3,如图甲所示。
方法三:利用红外光谱仪测得A分子的红外光谱如图乙所示。
 (3)、A的分子是否含有甲基(填“是”或“否”),理由是(填序号)。
(3)、A的分子是否含有甲基(填“是”或“否”),理由是(填序号)。a.A的分子式 b.A的相对分子质量
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(4)、经测定A中含有乙基,那么A的结构简式为。(5)、A的芳香类同分异构体有多种,其中符合下列条件的同分异构体共有种。①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基
19. 丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
已知:
 (1)、A的名称为。(2)、C中官能团的名称为。(3)、请写出H→J反应的化学方程式: , 该反应的类型是。最多能与发生反应。(4)、物质C可转化为X:。则X的结构简式为 , 写出满足下列条件的X的同分异构体的结构简式。
(1)、A的名称为。(2)、C中官能团的名称为。(3)、请写出H→J反应的化学方程式: , 该反应的类型是。最多能与发生反应。(4)、物质C可转化为X:。则X的结构简式为 , 写出满足下列条件的X的同分异构体的结构简式。①除苯环外无其它环,且苯环上的一氯代物只有两种沸点
②该同分异构体与足量银氨溶液反应,生成固体
③C与X可用显色反应鉴别
(5)、参照题中信息写出以乙烯和甲苯为原料,合成 的路线流程图(其它试剂自选)。 20. 检验甲醛含量的方法有很多,其中银-Ferrozine法灵敏度较高。测定原理为甲醛把氧化银还原成Ag,产生的Ag与定量反应生成 , 与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。
的路线流程图(其它试剂自选)。 20. 检验甲醛含量的方法有很多,其中银-Ferrozine法灵敏度较高。测定原理为甲醛把氧化银还原成Ag,产生的Ag与定量反应生成 , 与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。
已知:甲醛和银氨溶液反应生成单质银,氮化镁与水反应放出 , 毛细管内径不超过。
请回答下列问题:
(1)、B中装的试剂是 , 仪器B的名称为。(2)、A装置中反应的化学方程式为 , 用饱和食盐水代替水制备的原因是。(3)、银氨溶液的制备。关闭 , 打开 , 打开分液漏斗的活塞与旋塞,使饱和食盐水慢慢滴入圆底烧瓶中,当观察到B中 , 停止通。(4)、室内空气中甲醛含量的测定。①用热水浴加热B,打开 , 将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气,关闭;后续操作是打开 , 缓慢推动滑动隔板,将气体全部推出,再关闭;再重复上述操作3次。毛细管的作用是。B中甲醛和银氨溶液反应方程式为:。
②向上述B中充分反应后的溶液中加入稀硫酸调节溶液 , 再加入足量溶液,充分反应后立即加入菲洛嗪,与菲洛嗪形成有色物质,在处测定吸光度,测得生成 , 空气中甲醛的含量。