江西省抚州市七校2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 开发氢能源对改善能源结构和缓解环境压力意义重大。下列说法错误的是( )A、氢能源属于可再生的清洁能源 B、氢气沸点低便于储存和运输 C、氢能源广泛使用有利于实现碳达峰 D、水分解制氢气的反应一定条件下属于自发反应2. “84”消毒液是一种以NaClO为主的高效消毒剂,在新冠肺炎防治中被广泛应用于宾馆、旅游、医院、家庭等的卫生消毒。某“84”消毒液瓶体部分标签如图1所示,该“84”消毒液通常稀释100倍(体积之比)后使用。下列叙述正确的是( )
 A、根据图1信息,不能求出此“84”消毒液中NaClO的物质的量浓度 B、某同学参阅该“84”消毒液的配方,欲用NaClO固体配制480mL含NaClO质量分数为24%的消毒液。除选用图2所示的部分仪器外,还缺少的玻璃仪器有两种 C、若配制上述溶液,定容时俯视刻度线会导致所配溶液的物质的量浓度偏低 D、为增强“84”消毒液的消毒效果,可加入适量稀盐酸3. 实验室常用燃烧法分析有机物的组成与结构。某化合物样品在足量O2中充分燃烧,生成物只有CO2和H2O。燃烧产物依次经过浓硫酸和碱石灰充分吸收,浓硫酸和碱石灰依次增重7.2g和17.6g。有关该物质的组成和结构推测不合理的是( )A、该物质可能是烃类化合物 B、该物质结构中可能含C=C C、该物质结构中可能含苯环 D、该物质结构中可能含羧基4. 用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、中含有的质子数与中子数均为5NA B、常温常压下,与混合物中含有的氧原子数目为0.2NA C、溶液中,含有的数目约为0.3NA D、加热含的饱和溶液最多可形成胶体粒子数为NA5. 等质量的、两种短周期金属粉末,分别与足量的盐酸溶液反应,产生体积(同温同压)与时间的关系如图所示。提示:用单位时间内固体质量变化表示固体与酸反应的速率。下列推断可能正确的是( )
A、根据图1信息,不能求出此“84”消毒液中NaClO的物质的量浓度 B、某同学参阅该“84”消毒液的配方,欲用NaClO固体配制480mL含NaClO质量分数为24%的消毒液。除选用图2所示的部分仪器外,还缺少的玻璃仪器有两种 C、若配制上述溶液,定容时俯视刻度线会导致所配溶液的物质的量浓度偏低 D、为增强“84”消毒液的消毒效果,可加入适量稀盐酸3. 实验室常用燃烧法分析有机物的组成与结构。某化合物样品在足量O2中充分燃烧,生成物只有CO2和H2O。燃烧产物依次经过浓硫酸和碱石灰充分吸收,浓硫酸和碱石灰依次增重7.2g和17.6g。有关该物质的组成和结构推测不合理的是( )A、该物质可能是烃类化合物 B、该物质结构中可能含C=C C、该物质结构中可能含苯环 D、该物质结构中可能含羧基4. 用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、中含有的质子数与中子数均为5NA B、常温常压下,与混合物中含有的氧原子数目为0.2NA C、溶液中,含有的数目约为0.3NA D、加热含的饱和溶液最多可形成胶体粒子数为NA5. 等质量的、两种短周期金属粉末,分别与足量的盐酸溶液反应,产生体积(同温同压)与时间的关系如图所示。提示:用单位时间内固体质量变化表示固体与酸反应的速率。下列推断可能正确的是( ) A、、的摩尔质量之比为9∶8 B、、的最高正化合价之比为2∶3 C、、的反应速率之比为1∶3 D、等物质的量的、完全反应生成的质量之比为3∶46. 甲烷与氯气光照条件下取代反应的部分反应历程和能量变化如下:
A、、的摩尔质量之比为9∶8 B、、的最高正化合价之比为2∶3 C、、的反应速率之比为1∶3 D、等物质的量的、完全反应生成的质量之比为3∶46. 甲烷与氯气光照条件下取代反应的部分反应历程和能量变化如下:第一步:
第二步:
第三步:中其中表示氯原子,表示甲基 , 下列说法错误的是( )
A、由题可知,甲烷和氯气在室温暗处较难反应 B、 C、形成中键放出的能量比拆开中化学键吸收的能量多 D、若是甲烷与发生取代反应,则第二步反应7. 下列有关反应热的叙述中正确的是( )①已知 , 则氢气的燃烧热;
②单质A和单质B互为同素异形体,由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定;
③ , 恒温恒压条件下达到平衡后加入X,上述反应的增大;
④根据下表数据可以计算出3H2+

 的焓变;
的焓变;共价键
C-C
C-H
H-H
键能/()
348
610
413
436
⑤根据盖斯定律可推知在相同条件下,金刚石或石墨燃烧生成1mol(g)时,放出的热量相等;
⑥25℃、101kPa时,1mol碳完全燃烧生成(g)所放出的热量为碳的燃烧热。
A、①②③④ B、③④⑤ C、④⑤ D、⑥8. 已知催化氧化生成的热化学方程式为 。设为阿伏加德罗常数的值。下列有关叙述正确的是( )A、1mol和混合气体中硫原子数目为 B、等物质的量的和 , 的中子数比的中子数多 C、当放出39.6kJ热量时,消耗的分子数为 D、标准状况下,中所含有的原子数目为9. 常温常压下,在催化剂的作用下合成2-甲基丙酸甲酯的转化关系如图所示,计算机模拟单个分子在催化剂表面的反应历程如图所示,下列说法错误的是( ) A、总反应的热化学方程式为 B、第一步反应决定了总反应的化学反应速率 C、
A、总反应的热化学方程式为 B、第一步反应决定了总反应的化学反应速率 C、 是反应的催化剂
D、的能量比1mol、1molCO、1mol的总能量低
10. 同温同压下,甲容器中充满35Cl2 , 乙容器中充满37Cl2 , 下列叙述错误的是( )A、若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37 B、若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37 C、若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35 D、若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶1011. 下列实验装置、操作均正确的是( )
是反应的催化剂
D、的能量比1mol、1molCO、1mol的总能量低
10. 同温同压下,甲容器中充满35Cl2 , 乙容器中充满37Cl2 , 下列叙述错误的是( )A、若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37 B、若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37 C、若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35 D、若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶1011. 下列实验装置、操作均正确的是( )



甲
乙
丙
丁
A、装置甲:分离乙醇和乙酸 B、装置乙:证明碳酸酸性强于苯酚 C、装置丙:银镜反应 D、装置丁:实验室制备乙烯12. 麦芽糖主要存在于发芽的谷粒中,其α-D-(+)-麦芽糖的结构如图所示,下列相关说法中正确的是( )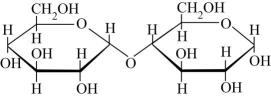 A、麦芽糖是一种常见的寡糖 B、如图麦芽糖分子结构中无醛基,因此属于非还原糖 C、麦芽糖由一分子葡萄糖和一分子果糖脱水缩合形成 D、将麦芽糖水解液调至碱性后,可发生银镜反应,证明部分麦芽糖发生了水解13. “连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物。下列有关该有机物的说法错误的是( )
A、麦芽糖是一种常见的寡糖 B、如图麦芽糖分子结构中无醛基,因此属于非还原糖 C、麦芽糖由一分子葡萄糖和一分子果糖脱水缩合形成 D、将麦芽糖水解液调至碱性后,可发生银镜反应,证明部分麦芽糖发生了水解13. “连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物。下列有关该有机物的说法错误的是( ) A、该物质中碳原子的杂化方式均为 B、1mol该分子最多可与发生加成反应 C、分子中所有原子可能处于同一平面 D、1mol该物质最多能与溶液反应14. 化合物M是合成具有抗拒活性中药的中间体,其结构如图所示。下列关于M的说法正确的是( )
A、该物质中碳原子的杂化方式均为 B、1mol该分子最多可与发生加成反应 C、分子中所有原子可能处于同一平面 D、1mol该物质最多能与溶液反应14. 化合物M是合成具有抗拒活性中药的中间体,其结构如图所示。下列关于M的说法正确的是( )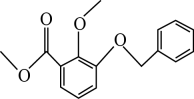 A、与
A、与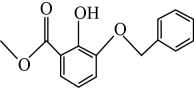 互为同系物
B、能使的溶液褪色
C、1molM最多能与7mol发生加成反应
D、氢原子发生氯代时,一氯代物有9种(不含立体异构)
互为同系物
B、能使的溶液褪色
C、1molM最多能与7mol发生加成反应
D、氢原子发生氯代时,一氯代物有9种(不含立体异构)
二、非选择题
-
15. 回答下列问题(1)、Ⅰ.下列几种均属于烃的含氧衍生物,请按要求作答:
①
 ②
②
③
 ④
④
一定条件下①可以转化为④,下列试剂中能实现该转化的是____(填字母)。
A、高锰酸钾溶液 B、H2 C、新制的Cu(OH)2悬浊液/H+ D、氢氧化钠溶液(2)、请写出满足下列条件的①的同分异构体:。A.分子中除苯环外不含其他环状结构
B.苯环上一氯代物有三种
C.能与溴水中的Br2按1∶4进行反应
(3)、①②③三种有机物水溶性由大到小的顺序为(填序号),它们互为。(4)、C的分子式为。(5)、C→D的反应类型为。(6)、化合物D可能具有的性质有____ (填字母)。A、氧化反应 B、加成反应 C、消去反应 D、酯化反应 E、与FeCl3溶液发生显色反应(7)、化合物B经3步反应可制备 , 反应类型依次是____ (填字母)。 A、加成、取代、消去 B、取代、消去、加成 C、消去、加成、取代16. 有机合成在制药工业领域有着不可或缺的重大应用价值。某种新药有机物J是采用芳香烃A和不饱和烃D作为原料通过一系列反应进行合成的,具体合成路线如下:
, 反应类型依次是____ (填字母)。 A、加成、取代、消去 B、取代、消去、加成 C、消去、加成、取代16. 有机合成在制药工业领域有着不可或缺的重大应用价值。某种新药有机物J是采用芳香烃A和不饱和烃D作为原料通过一系列反应进行合成的,具体合成路线如下:
已知:①

②有机物J结构中含两个环。
回答下列问题:
(1)、D的结构简式为 , D的同分异构体中具有顺反异构的分子X的核磁共振氢谱显示的峰面积之比为。(2)、的反应类型为。(3)、的化学反应方程式为。的化学反应方程式为。(4)、符合下列条件的H的同分异构体有种。①官能团与苯环直接相连 ②苯环上有三个取代基 ③与溶液反应产生气泡
(5)、利用题中信息和所学知识,写出以A和甲烷为原料(其他试剂自选),合成 的路线流程图:。 17. B是合成某药物的中间体,一种合成B的路线如下:
的路线流程图:。 17. B是合成某药物的中间体,一种合成B的路线如下:
已知:
 。(1)、多取代基有机物命名,选取主要官能团为主官能团,其他官能团作为取代基。例如,官能团主次排序为—COOH>—CHO>—OH>—X(卤素原子)。根据系统命名法规则,W的名称是。(2)、Z→A的反应试剂和条件是。(3)、W→X的反应类型是。设计W→X、A→B步骤的目的是。(4)、写出A→B的化学方程式:。(5)、有机物R的结构简式为 , 其核磁共振氢谱上有组峰。(6)、写出一种同时满足下列条件的X的同分异构体的结构简式:。
。(1)、多取代基有机物命名,选取主要官能团为主官能团,其他官能团作为取代基。例如,官能团主次排序为—COOH>—CHO>—OH>—X(卤素原子)。根据系统命名法规则,W的名称是。(2)、Z→A的反应试剂和条件是。(3)、W→X的反应类型是。设计W→X、A→B步骤的目的是。(4)、写出A→B的化学方程式:。(5)、有机物R的结构简式为 , 其核磁共振氢谱上有组峰。(6)、写出一种同时满足下列条件的X的同分异构体的结构简式:。①能发生银镜反应
②遇溶液发生显色反应
③核磁共振氢谱显示峰面积之比为6∶2∶1∶1
(7)、参照上述流程,以 为原料合成
为原料合成 , 设计合成路线:(无机物自选)。 18. 苯胺是一种重要精细化工原料,在染料、医药等行业中具有广泛的应用。实验室以苯为原料制取苯胺,其原理简示如下:
, 设计合成路线:(无机物自选)。 18. 苯胺是一种重要精细化工原料,在染料、医药等行业中具有广泛的应用。实验室以苯为原料制取苯胺,其原理简示如下: +HNO3
+HNO3 +H2O
+H2O +3H2
+3H2  +2H2O
+2H2O物质
相对分子质量
沸点/℃
密度g/mL
溶解性
硝基苯
123
210.9
1.23
不溶于水,易溶于乙醇、乙醚
苯胺
93
184.4
1.02
微溶于水,易溶于乙醇、乙醚;
还原性强、易被氧化
(1)、I.制取硝基苯实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液漏斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。

请回答下列问题:
实验装置中长玻璃管可以用代替(填仪器名称)。
(2)、下列说法中正确的是____(填序号)。A、配制混酸时,将浓硝酸沿杯壁缓缓加入浓硫酸中,并不断搅拌、冷却 B、温度控制在50~60 ℃原因之一是减少副反应的发生 C、制得的粗硝基苯可以先用乙醇萃取,分液后再洗涤 D、浓硫酸可以降低该反应活化能(3)、粗硝基苯用5% NaOH溶液洗涤的目的是。(4)、II.制取苯胺①组装好实验装置(如下图,夹持仪器已略去),并检查气密性。

②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
③打开活塞K,通入H2一段时间。
④利用油浴加热,使反应液温度维持在140 ℃进行反应。
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186 ℃馏分,得到较纯苯胺。
回答下列问题:
步骤②中温度计水银球的位置位于(填序号,下同),步骤⑥中位于。
A.烧瓶内反应液中
B.贴近烧瓶内液面处
C.三颈烧瓶出气口(等高线)附近
(5)、若实验中步骤③和④的顺序颠倒,则实验中可能产生的不良后果是。(6)、步骤⑤中,加入生石灰的作用是。(7)、若实验中硝基苯用量为10 mL,最后得到苯胺5.6 g,苯胺的产率为(计算结果精确到0.1%)。