江苏省泰州市2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 有机化合物是生命活动的基础。下列有关糖类、蛋白质、核酸的说法正确的是( )A、糖类的组成都符合通式 B、淀粉和纤维素互为同分异构体 C、蛋白质只含有C、H、O三种元素 D、双螺旋结构中存在氢键2. 是常见的补铁剂。下列说法正确的是( )A、中子数为10的氧原子: B、其中碳原子的杂化类型:和 C、的名称:胺基 D、基态的价电子的排布图:
 3. 下列有机物的系统命名正确的是( )A、
3. 下列有机物的系统命名正确的是( )A、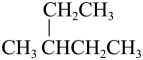
2-乙基丁烷
B、
2-甲基-3-丁烯
C、
2-甲基-1-丙醇
D、
2,4,6-三溴苯酚4. 下列制备少量硝基苯的实验原理和装置不能达到实验目的的是( )A、混合浓酸 B、水浴加热
B、水浴加热 C、水洗分液
C、水洗分液 D、蒸馏提纯
D、蒸馏提纯 5. 下列说法没有因果关系的是( )A、氧化铝熔点高,故作耐高温材料 B、聚乙炔能燃烧,故作导电高分子材料 C、浓硫酸具有吸水性,故用于干燥 D、电负性 , 故酸性6. 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下和可合成尿素。与苯酚经过一系列反应可制得水杨酸(沸点),水杨酸和甲醇(沸点)发生如下反应制取冬青油(沸点:
5. 下列说法没有因果关系的是( )A、氧化铝熔点高,故作耐高温材料 B、聚乙炔能燃烧,故作导电高分子材料 C、浓硫酸具有吸水性,故用于干燥 D、电负性 , 故酸性6. 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下和可合成尿素。与苯酚经过一系列反应可制得水杨酸(沸点),水杨酸和甲醇(沸点)发生如下反应制取冬青油(沸点: +CH3OH
+CH3OH +H2O。下列说法正确的是( ) A、是极性分子 B、第一电离能: C、
+H2O。下列说法正确的是( ) A、是极性分子 B、第一电离能: C、 的沸点高于
D、在合成尿素的反应中作氧化剂
7. 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下和可合成尿素。与苯酚经过一系列反应可制得水杨酸(沸点),水杨酸和甲醇(沸点)发生如下反应制取冬青油(沸点:
的沸点高于
D、在合成尿素的反应中作氧化剂
7. 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下和可合成尿素。与苯酚经过一系列反应可制得水杨酸(沸点),水杨酸和甲醇(沸点)发生如下反应制取冬青油(沸点: +CH3OH
+CH3OH +H2O。对于水杨酸制备冬青油的反应,下列说法错误的是( ) A、若用进行示踪,可得产物
+H2O。对于水杨酸制备冬青油的反应,下列说法错误的是( ) A、若用进行示踪,可得产物 B、可边反应边蒸馏出冬青油以提高水杨酸的转化率
C、油层厚度不再变化说明该反应已达到化学平衡状态
D、加入适量浓硫酸既能加快反应速率又能提高冬青油的产率
8. 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下和可合成尿素。与苯酚经过一系列反应可制得水杨酸(沸点),水杨酸和甲醇(沸点)发生如下反应制取冬青油(沸点:
B、可边反应边蒸馏出冬青油以提高水杨酸的转化率
C、油层厚度不再变化说明该反应已达到化学平衡状态
D、加入适量浓硫酸既能加快反应速率又能提高冬青油的产率
8. 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下和可合成尿素。与苯酚经过一系列反应可制得水杨酸(沸点),水杨酸和甲醇(沸点)发生如下反应制取冬青油(沸点: +CH3OH
+CH3OH +H2O。在指定条件下,下列选项所示的物质间转化不能实现的是( ) A、
+H2O。在指定条件下,下列选项所示的物质间转化不能实现的是( ) A、 B、
B、 C、
C、 D、
D、 9. 溶液可用于蚀刻铜,向蚀刻生成的溶液中加入并通入可使溶液再生。下列说法正确的是( )
9. 溶液可用于蚀刻铜,向蚀刻生成的溶液中加入并通入可使溶液再生。下列说法正确的是( ) A、中键的数目为 B、晶体中既有离子键又有非极性共价键 C、晶体(晶胞见如图)中与1个距离最近的有8个 D、再生反应的离子方程式为10. 液氨中存在平衡: , 用情性电极电解的液氨溶液的装置如图所示。下列说法正确的是( )
A、中键的数目为 B、晶体中既有离子键又有非极性共价键 C、晶体(晶胞见如图)中与1个距离最近的有8个 D、再生反应的离子方程式为10. 液氨中存在平衡: , 用情性电极电解的液氨溶液的装置如图所示。下列说法正确的是( ) A、的键角小于键角 B、电极b连接电源正极 C、电解液中不定向移动 D、a极发生的反应为11. 化合物Y是合成治疗新冠肺炎药物阿比朵尔的中间体,可由下列反应制得:
A、的键角小于键角 B、电极b连接电源正极 C、电解液中不定向移动 D、a极发生的反应为11. 化合物Y是合成治疗新冠肺炎药物阿比朵尔的中间体,可由下列反应制得: 。下列说法正确的是( )A、X分子存在顺反异构现象 B、X与Y分子组成相差一个 C、相同条件下,Y在盐酸中的溶解性大于在水中的溶解性 D、与足量溶液反应最多可消耗12. 的氯代反应是自由基(如、)反应,机理如下:
。下列说法正确的是( )A、X分子存在顺反异构现象 B、X与Y分子组成相差一个 C、相同条件下,Y在盐酸中的溶解性大于在水中的溶解性 D、与足量溶液反应最多可消耗12. 的氯代反应是自由基(如、)反应,机理如下:I.链引发
II.链传递
III.链终止
……
……
下列说法正确的是( )
A、链引发吸收能量,链终止放出能量 B、氯代可以得到纯净的 C、光照后,在黑暗中与混合,也可以得到氯代甲烷 D、生成的链传递方程式为13. 室温下,通过下列实验探究 , 溶液的性质。已知: , 。实验
实验操作和现象
1
用试纸测量溶液的 , 测得为a
2
将为10的溶液加热一段时间后恢复至室温,测得为9
3
将浓度均为和溶液等体积混合,有沉淀产生
4
溶液中加入适量溶液,测得为7
下列说法正确的是( )
A、实验1中, B、实验2中,变小是因为水分蒸发增大 C、由实验3不能得出: D、实验4所得溶液中:14. 在一定空气流速下,热解得到三种价态锰的氧化物。相同时间内锰元素所占比例()随热解温度变化的曲线如图所示。坐标系中主要发生如下反应:反应I:
反应II:
反应III:
下列说法错误的是( )

 A、反应I在低温下不能自发进行,说明 B、曲线a表示中锰元素所占比例随温度的变化温度/C C、 , 主要发生反应III D、下,适当增大空气的流速可以提高的产率
A、反应I在低温下不能自发进行,说明 B、曲线a表示中锰元素所占比例随温度的变化温度/C C、 , 主要发生反应III D、下,适当增大空气的流速可以提高的产率二、非选择题
-
15. 处理含的废水(含量均超标)的流程如下:

已知:①时, , 。
②室温下,溶液中(III)物种分布分数与的关系如图所示。
 (1)、“过程I”除及部分砷。
(1)、“过程I”除及部分砷。①基态As的核外电子排布式为。
②用离子方程式表示溶液呈碱性的原因。
(2)、“过程II”除和。测得滤液中 , 此时。(3)、“过程III”进一步除砷。(聚合硫酸铁)溶于水形成的胶体和加入的可将砷转化为难溶的除去。①生成的离子方程式为。
②测定“滤渣C”中含量。称取样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取溶液于锥形瓶中,依次加入足量的溶液和溶液。充分反应后,用标准溶液滴定至终点,平行滴定3次,平均消耗溶液。
(已知: , ;与反应生成 , 氧化性。)
i.加入足量的溶液的作用为。
ii.计算样品中的质量分数(写出计算过程)。
16. 柠檬醛合成二氢猕猴桃内酯的路线如下 (1)、化合物F中含有的手性碳原子数目是。(2)、丙酮的反应经历两步,第二步是消去反应,第一步的反应类型为。(3)、根据的反应判断,
(1)、化合物F中含有的手性碳原子数目是。(2)、丙酮的反应经历两步,第二步是消去反应,第一步的反应类型为。(3)、根据的反应判断, 在碱溶液中水解产物的结构简式为。 (4)、写出同时满足下列条件的G的一种同分异构体的结构简式。
在碱溶液中水解产物的结构简式为。 (4)、写出同时满足下列条件的G的一种同分异构体的结构简式。①可与溶液发生显色反应 ②分子中有4种不同化学环境的氢
(5)、写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂、不超过两个碳原子的有机物及有机溶剂任用,合成路线流程图示例见本题题干) 。 17. 铁的腐蚀和防护与生产生活密切相关。已知:氢氧化物沉淀的如下表(开始沉淀时金属离子浓度为)。
的合成路线流程图(无机试剂、不超过两个碳原子的有机物及有机溶剂任用,合成路线流程图示例见本题题干) 。 17. 铁的腐蚀和防护与生产生活密切相关。已知:氢氧化物沉淀的如下表(开始沉淀时金属离子浓度为)。沉淀物
开始沉淀
1.1
5.8
5.9
完全沉淀
3.2
8.8
8.0
(1)、研究铁的腐蚀。将一定量铁粉和碳粉混合后置于一密闭容器中,加入和盐酸的混合溶液。测得溶液和压强随时间变化的曲线如所示。
①容器内压强先增大后减小,除温度影响外的原因是。
②反应过程中,混合液里先期生成的会被氧化生成 , 反应的离子方程式为。
③后略下降,原因是。
(2)、研究铁的防护。①在铁表面镀锌可有效防止铁被腐蚀。
已知:镀层金属析出缓慢、平稳时,镀层致密、细腻;溶液中与可发生反应:。以通入一定量的溶液为电镀液热镀锌,得到的镀层更加致密、细腻,原因是。
②镀锌废液的回收。镀锌废液中含有等阳离子。请设计利用该电镀废液回收溶液的实验方案:。(实验中可选用试剂:、溶液、氨水)
18. 乙二醇是重要的化工原料,通过下列过程可实现煤到乙二醇的转化。(1)、“气化”中主要反应:验共酬巷|反应I:
反应II:
反应的。
(2)、“转化1”中主要反应:反应III:
反应IV:
将和按一定比例投入恒容密闭容器中,分别在和下达到平衡,下平衡转化率更大、甲醇的产率较低,原因是。
(3)、“转化2”中的总反应为 , 该转化分为两步进行,第一步为 , 机理如图所示。
①化合物X的结构简式为。
②中混有的少量 , 会在表面形成中间体参与反应,生成的有机物有、。
③“转化2”的第二步为和进行的再生反应,反应的化学方程式为。
(4)、“转化3”生成乙二醇和甲醇,每生成乙二醇转移的电子为。