江苏省如皋市2021-2022学年高二下学期期末调研考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 免洗手消毒凝胶广泛用于公共场所,使用时只需将消毒凝胶在手部揉搓即可。一种免洗手消毒凝胶中含有下列成分,其中能起到消毒杀菌作用的是( )A、水 B、乙醇 C、甘油 D、丙烯酸交联树脂2. 下列说法正确的是( )A、基态原子的内层电子全部充满 B、中子数为8的氧原子可以表示为 C、与分子的极性相同 D、的空间构型为正四面体形3. 与在催化剂(简写为HAP)表面催化生成和的历程示意图如下。已知该反应在一定条件下能自发进行。下列说法正确的是 ( )
 A、E=反应物的键能总和-生成物的键能总和 B、羟基磷灰石(HAP)的作用是减小 , 加快反应速率 C、反应过程中既有极性键生成,也有非极性键生成 D、反应的4. 下列离子方程式书写正确的是( )A、向中加入盐酸: B、向Al粉中加入NaOH溶液: C、溶液中加入过量溶液: D、向碱性溶液中加入:5. Q、W、X、Y、Z为原子序数依次增大的短周期元素,Q的基态原子中只有1种运动状态的电子,W、Z的基态原子分别是同周期中未成对电子数最多的,X的基态原子2p能级上未成对电子数与成对电子数相同,Y与Q处于同一主族。下列说法正确的是( )A、简单离子半径: B、第一电离能: C、沸点: D、化合物中只含有离子键6. 在给定条件下,下列所示物质间的转化均能实现的是( )A、 B、 C、 D、7. 下列有关实验装置或原理能达到目的的是 ( )
A、E=反应物的键能总和-生成物的键能总和 B、羟基磷灰石(HAP)的作用是减小 , 加快反应速率 C、反应过程中既有极性键生成,也有非极性键生成 D、反应的4. 下列离子方程式书写正确的是( )A、向中加入盐酸: B、向Al粉中加入NaOH溶液: C、溶液中加入过量溶液: D、向碱性溶液中加入:5. Q、W、X、Y、Z为原子序数依次增大的短周期元素,Q的基态原子中只有1种运动状态的电子,W、Z的基态原子分别是同周期中未成对电子数最多的,X的基态原子2p能级上未成对电子数与成对电子数相同,Y与Q处于同一主族。下列说法正确的是( )A、简单离子半径: B、第一电离能: C、沸点: D、化合物中只含有离子键6. 在给定条件下,下列所示物质间的转化均能实现的是( )A、 B、 C、 D、7. 下列有关实验装置或原理能达到目的的是 ( ) A、用图甲装置制取沉淀 B、用图乙装置分离层和水层 C、用图丙装置制取乙酸乙酯 D、用图丁装置验证酸性:乙酸>碳酸>苯酚8. 以某治金工业产生的废渣(含)为原料制备的流程如下图所示。已知水浸后溶液中主要存在的离子是。
A、用图甲装置制取沉淀 B、用图乙装置分离层和水层 C、用图丙装置制取乙酸乙酯 D、用图丁装置验证酸性:乙酸>碳酸>苯酚8. 以某治金工业产生的废渣(含)为原料制备的流程如下图所示。已知水浸后溶液中主要存在的离子是。
下列说法正确的是( )
A、“煅烧”时发生的反应都是氧化还原反应 B、高温“煅烧”时每消耗 , 则同时消耗 C、“除杂”时反应之一为 D、“反应”时发生复分解反应,该反应能发生的原因是该条件下的溶解度相对和较小,有沉淀析出9. 有机物Y是一种食用香精,波谱法检测分子中含有苯环、碳碳双键和醛基。现对Y进行如下实验:步骤1:向一支试管中加入少量Y,滴加几滴酸性溶液,紫红色褪去;
步骤2:向另一支试管中加入的溶液,边振荡边滴入2%的稀氨水;
步骤3:向步骤2所得银氨溶液中加入少量Y,加热,出现银镜。
下列说法正确的是 ( )
 A、测定Y分子中含有苯环、碳碳双键和醛基的波谱法是质谱法 B、步骤1能说明碳碳双键可被酸性溶液氧化 C、步骤2中配制银氨溶液时,当生成的沉淀恰好溶解时应停止滴加稀氨水 D、一个晶胞(见图)中,距离每个原子最近的原子数是410. 环氧乙烷(
A、测定Y分子中含有苯环、碳碳双键和醛基的波谱法是质谱法 B、步骤1能说明碳碳双键可被酸性溶液氧化 C、步骤2中配制银氨溶液时,当生成的沉淀恰好溶解时应停止滴加稀氨水 D、一个晶胞(见图)中,距离每个原子最近的原子数是410. 环氧乙烷( )气体是一种重要的工业原料。一种制备环氧乙烷的装置原理如图所示。电解时向其中一电极区持续通入乙烯,充分电解后,将两电极区溶液混合反应可制得环氧乙烷。下列说法错误的是 ( )
)气体是一种重要的工业原料。一种制备环氧乙烷的装置原理如图所示。电解时向其中一电极区持续通入乙烯,充分电解后,将两电极区溶液混合反应可制得环氧乙烷。下列说法错误的是 ( ) A、电解时将移向阴极区 B、与的反应为加成反应 C、电路中每转移电子,则理论上可生成 D、两电极区溶液混合生成环氧乙烷的离子反应为HOCH2CH2Cl+OH-→
A、电解时将移向阴极区 B、与的反应为加成反应 C、电路中每转移电子,则理论上可生成 D、两电极区溶液混合生成环氧乙烷的离子反应为HOCH2CH2Cl+OH-→ ↑+H2O+Cl-
11. 已知。常温下,用的分别滴定的甲酸和的乙酸溶液,所得溶液的与溶液体积的关系如下图所示。下列说法正确的是 ( )
↑+H2O+Cl-
11. 已知。常温下,用的分别滴定的甲酸和的乙酸溶液,所得溶液的与溶液体积的关系如下图所示。下列说法正确的是 ( ) A、乙酸的电离程度 B、甲酸电离的方程式为 C、 D、当时,溶液的
A、乙酸的电离程度 B、甲酸电离的方程式为 C、 D、当时,溶液的二、多选题
-
12. 一种能抑制病毒活性的有机物X的结构如下图所示。下列关于X的说法正确的是 ( )
 A、X分子中所有原子可能共平面 B、能与溶液反应生成 C、能与甲醛发生缩聚反应 D、与足量加成后所得分子中含7个手性碳原子13. 在容积为2L的恒容密闭容器中充入、 , 在不同温度下发生反应: , 测得的转化率与时间的关系如下图所示。下列说法正确的是 ( )
A、X分子中所有原子可能共平面 B、能与溶液反应生成 C、能与甲醛发生缩聚反应 D、与足量加成后所得分子中含7个手性碳原子13. 在容积为2L的恒容密闭容器中充入、 , 在不同温度下发生反应: , 测得的转化率与时间的关系如下图所示。下列说法正确的是 ( ) A、时,时的反应速率大于时,其中时 B、时的反应平衡常数 C、时,当容器中气体密度不再发生变化时,反应到达平衡状态 D、时,若起始向容器中加入催化剂,2s时,的转化率可能到达图中X点
A、时,时的反应速率大于时,其中时 B、时的反应平衡常数 C、时,当容器中气体密度不再发生变化时,反应到达平衡状态 D、时,若起始向容器中加入催化剂,2s时,的转化率可能到达图中X点三、非选择题
-
14. 碱式碳酸锌在医药行业可用作皮肤保护剂,用工业级硫酸锌(主要成分为 , 含少量)制备碱式碳酸锌的流程如下:
 (1)、“除铁”时控制溶液的pH约为4,写出“除铁”的离子方程式:;(2)、写出“沉锌”的离子方程式:。15. 一种以硼镁石[主要含 , 还含有少量]为原料制取的工艺流程如下:
(1)、“除铁”时控制溶液的pH约为4,写出“除铁”的离子方程式:;(2)、写出“沉锌”的离子方程式:。15. 一种以硼镁石[主要含 , 还含有少量]为原料制取的工艺流程如下: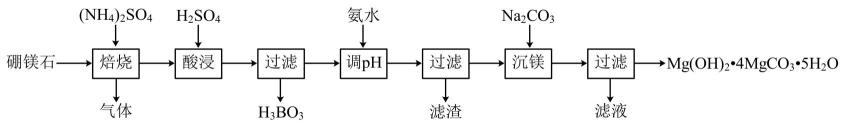 (1)、与焙烧时生成、、、、和。写出焙烧时发生反应的化学方程式:。(2)、由于部分铵盐的分解,焙烧反应所得的气体中除和外,还可能含有和 , 其中和的体积比为。(3)、易溶于水,溶于水后生成硼酸 , 硼酸在冷水中溶解度小,溶于水的硼酸可发生电离:
(1)、与焙烧时生成、、、、和。写出焙烧时发生反应的化学方程式:。(2)、由于部分铵盐的分解,焙烧反应所得的气体中除和外,还可能含有和 , 其中和的体积比为。(3)、易溶于水,溶于水后生成硼酸 , 硼酸在冷水中溶解度小,溶于水的硼酸可发生电离:
 。硼酸属于元酸。 (4)、用氨水调的目的是沉淀和 , 已知实验条件下,部分金属离子开始沉淀的和对应氢氧化物的如下表所示;溶液中金属离子浓度 , 可以认为沉淀完全。
。硼酸属于元酸。 (4)、用氨水调的目的是沉淀和 , 已知实验条件下,部分金属离子开始沉淀的和对应氢氧化物的如下表所示;溶液中金属离子浓度 , 可以认为沉淀完全。开始沉淀的
8.6
3.7
2.2
氢氧化物的
调时需控制的范围是。
(5)、取加热分解,所得残留固体的质量与温度的关系如下图所示。时所得固体的成分为。 16. 含铅废料的处理,有助于节约资源、保护环境。(1)、铅蓄电池废旧电极中的、用硫酸处理后可以制得。为加快反应,可以滴加少量溶液,滴加后主要发生2个反应,反应一是: , 写出反应二的离子方程式:。(2)、固体中含有少量炭黑,设计由混合物得到炭黑的实验方案: , 得到炭黑。(实验中必须要用的试剂是35%的溶液。已知在35%的溶液中的溶解度随温度的变化如图所示)
16. 含铅废料的处理,有助于节约资源、保护环境。(1)、铅蓄电池废旧电极中的、用硫酸处理后可以制得。为加快反应,可以滴加少量溶液,滴加后主要发生2个反应,反应一是: , 写出反应二的离子方程式:。(2)、固体中含有少量炭黑,设计由混合物得到炭黑的实验方案: , 得到炭黑。(实验中必须要用的试剂是35%的溶液。已知在35%的溶液中的溶解度随温度的变化如图所示) (3)、为测定废电极(含和)中的质量分数,进行如下实验:取粉碎后的废电极 , 向其中加入硫酸酸化,再加入足量的溶液,过滤除去 , 用的溶液滴定滤液至终点,恰好完全反应时消耗溶液。实验中发生的反应如下:
(3)、为测定废电极(含和)中的质量分数,进行如下实验:取粉碎后的废电极 , 向其中加入硫酸酸化,再加入足量的溶液,过滤除去 , 用的溶液滴定滤液至终点,恰好完全反应时消耗溶液。实验中发生的反应如下:(未配平)
(未配平)
①描述由固体配制的溶液的实验过程: , 用胶头滴管加水至凹液面与刻度线相切,塞好瓶塞,颠倒摇匀。【除必须用到电子天平(称量时可读数到)外,其他仪器任用】
②计算废电极中的质量分数,并写出计算过程。
17. 有机物H的一种合成路线如下图所示:
已知:

 (R表示烃基,当苯环上连有或时不能发生该反应)。(1)、B的结构简式为。(2)、D+F→G的反应类型为。(3)、X的结构简式为。(4)、C的一种同分异构体符合下列条件,写出该同分异构体的结构简式:
(R表示烃基,当苯环上连有或时不能发生该反应)。(1)、B的结构简式为。(2)、D+F→G的反应类型为。(3)、X的结构简式为。(4)、C的一种同分异构体符合下列条件,写出该同分异构体的结构简式:Ⅰ.既能发生银镜反应,也能发生水解反应;
Ⅱ.与溶液不能发生显色反应;
Ⅲ.含有苯环,分子中有4种化学环境不同的氢原子。
(5)、设计以 和
和 为原料取
为原料取 的路线图(无机试剂及有机溶剂任用)。 18. 有机物H是一种具有杀菌活性的物质,其合成路线如下:
的路线图(无机试剂及有机溶剂任用)。 18. 有机物H是一种具有杀菌活性的物质,其合成路线如下: (1)、A中碳原子的轨道杂化类型为。(2)、反应②可能生成一种与C互为同分异构体的副产物,该副产物的结构简式为。(3)、反应③的条件为。(4)、F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、A中碳原子的轨道杂化类型为。(2)、反应②可能生成一种与C互为同分异构体的副产物,该副产物的结构简式为。(3)、反应③的条件为。(4)、F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①分子中含2个苯环;
②与足量溶液共热后,经酸化后有两种有机产物甲和乙。甲分子含4种化学环境不同的氢,既能遇溶液显紫色也能与溶液反应,乙分子含3种化学环境不同的氢,遇溶液不能发生显色反应;
(5)、已知易被氧化,写出以和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图例见本题题干)。