湖南省岳阳市2021-2022学年高二下学期期末教学质量监测化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 化学与生产、生活密切相关。下列叙述正确的是( )A、燃煤脱硫有利于实现“碳达峰、碳中和” B、核酸检测是确认病毒类型的有效手段,核酸是高分子化合物 C、将“84”消毒液与75%酒精1:1混合,消毒效果更好 D、2022年北京冬奥会开幕式演出服用到的石墨烯发热材料属于有机高分子材料2. 下列化学用语或图示表达正确的是( )A、氯化氢的电子式:
 B、反-2-丁烯的球棍模型:
B、反-2-丁烯的球棍模型: C、的空间填充模型:
C、的空间填充模型: D、基态氮原子的轨道表示式:
D、基态氮原子的轨道表示式: 3. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、11gK2S和K2O2的混合物中含有的离子数目为0.3NA B、标准状况下,4.48LCCl4所含的分子数为0.2NA C、一定条件下,32gSO2与足量O2反应,转移的电子数为NA D、0.1mol·L-1Na2SO4溶液中含有的氧原子数为0.4NA4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有2个未成对电子,Y是地壳中含量最高的元素,金属元素Z的第一电离能小于同周期前一主族元素。的W的最高价氧化物对应的水化物溶液的pH=1。下列说法正确的是( )A、Y原子和W原子按2:1形成的分子空间构型为直线形 B、X氢化物的沸点都比Y的低 C、工业上常用电解熔融氧化物的方法冶炼乙单质 D、原子半径:5. 实验室处理废液,得到溴的四氯化碳溶液和。下列设计不能达到实验目的的是( )
3. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、11gK2S和K2O2的混合物中含有的离子数目为0.3NA B、标准状况下,4.48LCCl4所含的分子数为0.2NA C、一定条件下,32gSO2与足量O2反应,转移的电子数为NA D、0.1mol·L-1Na2SO4溶液中含有的氧原子数为0.4NA4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有2个未成对电子,Y是地壳中含量最高的元素,金属元素Z的第一电离能小于同周期前一主族元素。的W的最高价氧化物对应的水化物溶液的pH=1。下列说法正确的是( )A、Y原子和W原子按2:1形成的分子空间构型为直线形 B、X氢化物的沸点都比Y的低 C、工业上常用电解熔融氧化物的方法冶炼乙单质 D、原子半径:5. 实验室处理废液,得到溴的四氯化碳溶液和。下列设计不能达到实验目的的是( ) A、用装置甲制取氯气 B、用装置乙使全部转化为溴单质 C、用装置丙分液时,先从下口放出有机层,再从上口倒出水层 D、用装置丁将分液后的水层蒸干制得6. 下列性质的比较,错误的是( )A、酸性: B、电负性:F>O>N C、热稳定性: D、第一电离能:Mg>Al>Na7. 下列方程式与所给事实不相符的是( )A、乙酸与乙醇的酯化反应: B、酚酞滴入溶液中变为浅红色: C、冷凝气体得到液体: D、制备时,需除去溶液中的氧气防止发生:8. O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2 , 下列说法正确的是( )A、氧气是氧化产物 B、O2F2既是氧化剂又是还原剂 C、若生成4.48 L HF,则转移0.8 mol电子 D、还原剂与氧化剂的物质的量之比为1:49. 干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如图所示。下列说法错误的是( )
A、用装置甲制取氯气 B、用装置乙使全部转化为溴单质 C、用装置丙分液时,先从下口放出有机层,再从上口倒出水层 D、用装置丁将分液后的水层蒸干制得6. 下列性质的比较,错误的是( )A、酸性: B、电负性:F>O>N C、热稳定性: D、第一电离能:Mg>Al>Na7. 下列方程式与所给事实不相符的是( )A、乙酸与乙醇的酯化反应: B、酚酞滴入溶液中变为浅红色: C、冷凝气体得到液体: D、制备时,需除去溶液中的氧气防止发生:8. O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2 , 下列说法正确的是( )A、氧气是氧化产物 B、O2F2既是氧化剂又是还原剂 C、若生成4.48 L HF,则转移0.8 mol电子 D、还原剂与氧化剂的物质的量之比为1:49. 干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如图所示。下列说法错误的是( ) A、干冰晶体是共价晶体 B、每个晶胞中含有4个分子 C、每个分子周围有12个紧邻的分子 D、干冰升华时需克服分子间作用力10. 铁粉在弱酸性条件下去除废水中的反应原理如下图。
A、干冰晶体是共价晶体 B、每个晶胞中含有4个分子 C、每个分子周围有12个紧邻的分子 D、干冰升华时需克服分子间作用力10. 铁粉在弱酸性条件下去除废水中的反应原理如下图。
下列说法正确的是( )
A、上述条件下加入的能完全反应 B、正极的电极反应式: C、的产生与被氧化和溶液pH升高有关 D、废水中溶解氧的含量不会影响的去除率11. 在160℃、200℃条件下,分别向两个容积为2L的刚性容器中充入2molCO和2mol , 发生反应: 。实验测得两容器中CO或的物质的量随时间的变化关系如图所示。下列说法正确的是( ) A、ac段的平均反应速率为 B、逆反应速率:c=d>b C、160℃时,该反应的平衡常数K=9 D、当容器中混合气体的密度不随时间变化时,该反应达到平衡状态
A、ac段的平均反应速率为 B、逆反应速率:c=d>b C、160℃时,该反应的平衡常数K=9 D、当容器中混合气体的密度不随时间变化时,该反应达到平衡状态二、多选题
-
12. 下列实验操作、对应的现象及结论均正确的是( )
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变澄清
酸性:苯酚>碳酸
B
溶液中加入少量溶液,有砖红色沉淀()生成
C
将镁片和铝片用导线连接后插入NaOH溶液中,镁片表面产生气泡
该装置构成了原电池,铝片做负极
D
向某溶液中加入稀NaOH溶液,用湿润的红色石蕊试纸检验,无明显现象
溶液中一定无
A、A B、B C、C D、D13. 海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法错误的是( )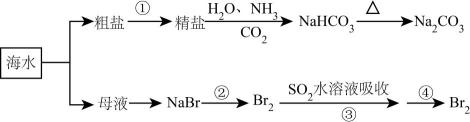 A、在第②③④步骤中,溴元素均被氧化 B、侯氏制碱过程中应先通再通 C、制取的反应是利用其溶解度小于NaCl D、③④的目的是进行溴的富集14. 溶液中含铁微粒的分布系数与pH的关系如图所示。下列说法正确的是( )
A、在第②③④步骤中,溴元素均被氧化 B、侯氏制碱过程中应先通再通 C、制取的反应是利用其溶解度小于NaCl D、③④的目的是进行溴的富集14. 溶液中含铁微粒的分布系数与pH的关系如图所示。下列说法正确的是( ) A、的数量级为 B、不论溶液酸碱性如何变化,铁元素都有4种存在形式 C、向pH=2的这种溶液中加氢氧化钠至pH=10,的分布分数逐渐增大 D、既能与强酸又能与强碱反应
A、的数量级为 B、不论溶液酸碱性如何变化,铁元素都有4种存在形式 C、向pH=2的这种溶液中加氢氧化钠至pH=10,的分布分数逐渐增大 D、既能与强酸又能与强碱反应三、综合题
-
15. 回收利用是目前解决空间站供氧问题的有效途径,其物质转化如下图:
 (1)、反应A为 , 是回收利用的关键步骤。
(1)、反应A为 , 是回收利用的关键步骤。已知:
反应A的。
(2)、将原料气按置于恒容密闭容器中发生反应A,在相同时间内测得的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高平衡转化率的措施有(写出一条即可)。
②温度过高或温度过低均不利于该反应的进行,原因是。
(3)、下列关于空间站内物质和能量变化的说法中,错误的是(填字母)。a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用作供氧剂的原因可能是不易实现循环利用
(4)、用代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是。(5)、利用电解可以实现和的耦合转化,其原理如图所示:
①电极A与电源的相连。
②电极B上的反应式为。
③若导线上转移电子数个,理论上A极产生CO的体积为L(标准状况下)。
16. 高铁酸钾()是一种新型、高效、多功能水处理剂。某化学实验小组模拟工业生产路线,在实验室中制备高铁酸钾,其实验装置如下:
已知:易溶于水,水溶液为紫色,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 , 在0℃~5℃、强碱性溶液中较稳定
(1)、仪器a的名称是。(2)、装置A中发生反应的离子方程式为。(3)、装置B中试剂为。(4)、装置C中观察到溶液的颜色变化为 , 发生主要反应的化学方程式为 , 加入过量浓KOH溶液的原因是。(5)、有同学提出,装置C在制备时存在一定缺陷,改进的措施是。(6)、取C中洗涤并干燥后样品10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为。(计算结果精确到0.1%)17. 硅是地壳中储量仅次于氧的元素,在自然界中主要以和硅酸盐的形式存在。(1)、基态硅原子的价电子排布式为。(2)、硅、金刚石和碳化硅晶体的熔点从高到低依次为。(3)、晶态的晶胞如图。
①硅原子的杂化方式为。
②已知晶胞的棱长均为a pm,则晶体的密度(列出计算式)。
(4)、硅元素最高价氧化物对应的水化物为原硅酸。资料:原硅酸(
 )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。①原硅酸钠溶液吸收空气中的会生成 , 结合元素周期律解释原因:。
②从结构的角度解释脱水后溶解度降低的原因:。
18. 某喹啉类化合物P的合成路线如下:
已知:R1-C≡CH+R2CHO
 (1)、有机物B的系统命名为。(2)、B→C的反应方程式是。(3)、C→D所需的试剂a是。(4)、下列关于E的说法正确的是。
(1)、有机物B的系统命名为。(2)、B→C的反应方程式是。(3)、C→D所需的试剂a是。(4)、下列关于E的说法正确的是。a.能发生银镜反应
b.能发生氧化、消去、加聚反应
c.核磁共振氢谱显示峰面积比为3:2:2:3
d.1molE可以与6-mol发生反应
(5)、H→I的反应类型为。(6)、由I和E合成P的流程如下,M与N互为同分异构体,写出J、M的结构简式:、。