湖南省郴州市2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 材料在人类文明史上起着划时代的意义,下列物品所用主要材料与类型的对应关系错误的是( )
A
B
C
D
 人面鱼纹陶盆
人面鱼纹陶盆
“马踏飞燕”铜奔马

宇航员的航天服

光导纤维
无机非金属材料
金属材料
有机高分子材料
复合材料
A、A B、B C、C D、D2. 下列化学用语正确的是( )A、的基态原子的核外电子排布为 B、次氯酸的结构式: C、钾原子最外层电子占据的能级符号:N D、硬脂酸与乙醇的酯化反应:3. 下列“类比”合理的是( )A、与反应生成和 , 则与反应生成和 B、与反应生成和 , 则与反应生成与 C、与盐酸反应生成和 , 则与盐酸反应生成和 D、溶液与少量溶液反应生成和 , 则氨水与少量溶液反应生成和4. 下列实验与平衡移动原理无关的是( )A
比较 在不同温度水浴中的颜色

B
配制 溶液

C
探究石灰石与稀盐酸在密闭环境下的反应

D
淀粉在不同条件下水解
 A、A B、B C、C D、D5. 以下反应均可制取O2。下列有关说法正确的是( )
A、A B、B C、C D、D5. 以下反应均可制取O2。下列有关说法正确的是( )反应①:2H2O(l)=2H2(g)+O2(g) △H1=+571.6 kJ·mol-1
反应②:2H2O2(l)=2H2O(1)+O2(g) △H2=-196.4 kJ·mol-1
A、制取O2的反应一定是吸热反应 B、H2的燃烧热为-571.6 kJ·mol-1 C、若使用催化剂,反应②的△H将减小 D、反应2H2O2(l)=2H2O(g)+O2(g)的△H>-196.4 kJ·mol-16. 短周期主族元素X、Y、Z、W的原子序数依次增大,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物的结构式为 。下列说法正确的是( ) A、第一电离能: B、W位于元素周期表的s区 C、电负性: D、简单气态氢化物的热稳定性:7. 已知为阿伏加德罗常数,下列有关说法正确的是:( )A、标况下,22.4L的四氯化碳含分子数为 B、1.0L1.0的水溶液中含有的氧原子数为3 C、某密闭容器中通入1和0.5后,容器内的分子数小于 D、1羟基与1氢氧根离子所含电子数均为98. 下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法错误的是 ( )
。下列说法正确的是( ) A、第一电离能: B、W位于元素周期表的s区 C、电负性: D、简单气态氢化物的热稳定性:7. 已知为阿伏加德罗常数,下列有关说法正确的是:( )A、标况下,22.4L的四氯化碳含分子数为 B、1.0L1.0的水溶液中含有的氧原子数为3 C、某密闭容器中通入1和0.5后,容器内的分子数小于 D、1羟基与1氢氧根离子所含电子数均为98. 下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法错误的是 ( ) A、对电极的电极反应为 B、半导体电极发生还原反应 C、电解质溶液中阳离子向对电极移动 D、整个过程中实现了太阳能→电能→化学能的转化9. 某有机化工原料的结构简式如右图所示。下列关于该有机物的说法正确的是 ( )
A、对电极的电极反应为 B、半导体电极发生还原反应 C、电解质溶液中阳离子向对电极移动 D、整个过程中实现了太阳能→电能→化学能的转化9. 某有机化工原料的结构简式如右图所示。下列关于该有机物的说法正确的是 ( ) A、一定条件下可以发生缩聚反应、加聚反应和氧化反应 B、能与溴水反应,最多生成3种产物 C、不能与芳香族化合物互为同分异构体 D、此有机物分别与足量的金属钠和碳酸氢钠溶液反应放出气体在相同条件下的体积比2∶110. 根据下列图示所得出的结论正确的是( )
A、一定条件下可以发生缩聚反应、加聚反应和氧化反应 B、能与溴水反应,最多生成3种产物 C、不能与芳香族化合物互为同分异构体 D、此有机物分别与足量的金属钠和碳酸氢钠溶液反应放出气体在相同条件下的体积比2∶110. 根据下列图示所得出的结论正确的是( ) A、图甲表示和体积相同的溶液与氨水稀释过程的变化,曲线a对应氨水 B、图乙是常温下用溶液滴定的滴定曲线,Q点表示酸碱中和滴定终点 C、图丙表示用溶液滴定浓度均为的、混合溶液时,随溶液体积的变化,说明 D、图丁表示不同温度水溶液中和的浓度变化,图中a点对应温度高于b点11. 下列离子方程式正确的是( )A、向溶液中通入过量: B、溶液中滴加足量的浓氨水: C、向苯酚溶液中滴加溶液:
A、图甲表示和体积相同的溶液与氨水稀释过程的变化,曲线a对应氨水 B、图乙是常温下用溶液滴定的滴定曲线,Q点表示酸碱中和滴定终点 C、图丙表示用溶液滴定浓度均为的、混合溶液时,随溶液体积的变化,说明 D、图丁表示不同温度水溶液中和的浓度变化,图中a点对应温度高于b点11. 下列离子方程式正确的是( )A、向溶液中通入过量: B、溶液中滴加足量的浓氨水: C、向苯酚溶液中滴加溶液: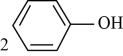
 D、向氯化亚铁溶液中滴加稀硝酸:
D、向氯化亚铁溶液中滴加稀硝酸:
二、多选题
-
12. 下列实验能达到预期目的是 ( )
编号
实验内容
实验目的
A
向含有酚酞的溶液中加入少量固体,溶液红色变浅
证明溶液中存在水解平衡
B
向35%溶液中滴加3-4滴2%的溶液,再向其中加入0.5乙醛
检验醛基
C
等体积的和两种酸分别与足量的铁反应,排水法收集气体,放出的氢气多且反应速率快
证明酸性比弱
D
向100.2溶液中滴2滴0.1溶液,产生白色沉淀后,再滴加2滴0.1溶液,又生成红褐色沉淀
证明在相同温度下:
A、A B、B C、C D、D13. 25℃时,向0.10溶液中逐渐加入固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)随溶液pH变化的关系如图所示,下列说法正确的是 ( ) A、曲线上任意一点均存在: B、时,溶液中的 C、由图可知,为二元弱酸,如果将物质的量浓度均为0.20的和溶液等体积混合,所得溶液的 D、已知25℃时,的。若把少量加入溶液中,发生的离子反应可表示为:14. 一种双功能结构催化剂能同时活化水和甲醇,用以解决氢气的高效存储和安全运输。下图是甲醇脱氢转化的反应历程(表示过渡态)
A、曲线上任意一点均存在: B、时,溶液中的 C、由图可知,为二元弱酸,如果将物质的量浓度均为0.20的和溶液等体积混合,所得溶液的 D、已知25℃时,的。若把少量加入溶液中,发生的离子反应可表示为:14. 一种双功能结构催化剂能同时活化水和甲醇,用以解决氢气的高效存储和安全运输。下图是甲醇脱氢转化的反应历程(表示过渡态)
下列说法正确的是( )
A、的脱氢反应是分步进行的 B、甲醇脱氢反应历程的最大能垒(活化能)是 C、甲醇脱氢反应中断裂了极性键和非极性键 D、该催化剂的研发为醇类重整产氢的工业应用提供了新思路三、非选择题
-
15. 以镁铝复合氧化物()为载体的负载型镍-铜双金属催化剂()是一种新型高效加氢或脱氢催化剂,其制备流程如下:

已知:常温下, , 。回答下列问题:
(1)、在加热条件下,尿素在水中发生水解反应,放出和气体(写化学式)。(2)、“洗涤”过程中,检验滤饼是否洗净的方法。(3)、常温下,若“悬浊液”中 , 则溶液的。(4)、在强碱溶液中被氧化可得 , 该物质能用作碱性镍镉电池的正极材料。其电池反应式:①放电一段时间后,溶液的pH将(填“增大”“减小”或“不变”)。
②充电时,阳极发生的电极反应。
16. 是重要的基础化工原料,某兴趣小组准备用三氯化磷、氯气、二氧化硫制备 , 产物中还有一种遇水强烈水解的物质(查资料可知遇水强烈水解,易与氧气反应;遇水强烈水解,能溶于)。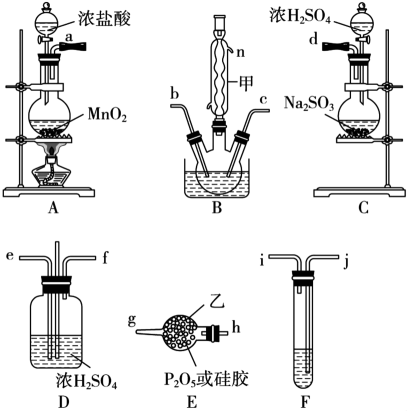 (1)、已知装置A制备 , 装置C制备 , 装置B制备 , 以上仪器接口连接的顺序为ah-d,装置B中发生反应的化学方程式为。(2)、装置F中试剂的名称为 , 仪器甲的名称为。(3)、此实验设计中有一不足之处是。(4)、测定含量。准确称取12.0g产品,置于盛有100蒸馏水的水解瓶中摇动至完全水解,取10.0水解液于烧杯中,加入足量的硝酸酸化的溶液,充分反应得到白色沉淀过滤、洗涤、烘干,称重为2.87g.产品中的百分含量为。(已知的相对分子质量为153.5)17. 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,许多科学家都在大力研究利用和以减少碳的排放。(1)、“神十三”中航天员们呼吸产生的用一种循环方案处理,即 , 然后电解水又得氢气和氧气。在温度为T,向一恒容密闭容器中,按物质的量之比2∶1通入和z,测得反应过程中压强(p)随时间(t)的变化如图中a所示,若其它条件不变,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图中b所示。
(1)、已知装置A制备 , 装置C制备 , 装置B制备 , 以上仪器接口连接的顺序为ah-d,装置B中发生反应的化学方程式为。(2)、装置F中试剂的名称为 , 仪器甲的名称为。(3)、此实验设计中有一不足之处是。(4)、测定含量。准确称取12.0g产品,置于盛有100蒸馏水的水解瓶中摇动至完全水解,取10.0水解液于烧杯中,加入足量的硝酸酸化的溶液,充分反应得到白色沉淀过滤、洗涤、烘干,称重为2.87g.产品中的百分含量为。(已知的相对分子质量为153.5)17. 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,许多科学家都在大力研究利用和以减少碳的排放。(1)、“神十三”中航天员们呼吸产生的用一种循环方案处理,即 , 然后电解水又得氢气和氧气。在温度为T,向一恒容密闭容器中,按物质的量之比2∶1通入和z,测得反应过程中压强(p)随时间(t)的变化如图中a所示,若其它条件不变,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图中b所示。
①能说明容器中的反应均已达到平衡状态的是。
A.容器内气体的平均相对分子质量不变 B.和的转化率相等
C.与的物质的量之比保持不变 D.
②根据反应过程中压强(p)和时间(t)的关系图可知,0(填“>”“<”或“不确定”)。
③改变的条件是。
(2)、经催化加氢可以生成低碳有机物,主要有以下反应:反应Ⅰ:
反应Ⅱ:
①反应Ⅱ的活化能(正)(逆)(填“>”“<”或“=”)。
②在T温度下,将3和7充入2L的恒容密闭容器中发生反应Ⅰ和Ⅱ,达到平衡状态时和的物质的量分别为1和0.5。则温度时反应Ⅰ的平衡常数。
18. 第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:(1)、比较铁与锰的第三电离能():铁锰(填“>”“<”或“=”)。(2)、已知与甲醛在水溶液中发生反应可生成一种新物质 , 试判断新物质中碳原子的杂化方式;1中的键数为。(3)、如图是晶体的晶胞,该晶体是一种磁性材料,能导电。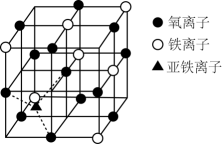
①晶胞中二价铁离子处于氧离子围成的(填空间结构)空隙。
②若晶胞的体对角线长为a , 则晶体的密度为(阿伏加德罗常数用表示)。
19. A与D是常见的有机化工原料,下列路线合成香料M(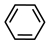 ):
):

已知以下信息:
①A的相对分子质量为28
②
(1)、A的结构简式是。(2)、A生成B的反应类型为 , G中官能团名称为。(3)、E生成F的化学方程式为。(4)、化合物M的同系物N比M相对分子质量大14,N的同分异构体中同时满足下列条件的共有种(不考虑立体构)。①与化合物M含有相同的官能团; ②苯环上有两个邻位取代基
(5)、试写出由乙炔合成1-丁醛的合成路线。