广东省肇庆市2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 北京冬奥会“冰墩墩”“雪容融”成为顶流,其主要采用环保PVC、PC、ABS以及亚克力等环保材料组合制作而成,下列说法错误的是( )
 A、PVC(
A、PVC(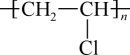 )不宜用于食品包装
B、PC(
)不宜用于食品包装
B、PC(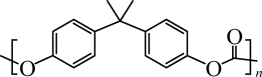 )可通过缩合聚合反应制得
C、ABS的单体中丁二烯与苯乙烯互为同系物
D、亚克力(聚甲基丙烯酸甲酯树脂)为混合物
2. 有机物M(
)可通过缩合聚合反应制得
C、ABS的单体中丁二烯与苯乙烯互为同系物
D、亚克力(聚甲基丙烯酸甲酯树脂)为混合物
2. 有机物M(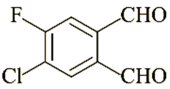 )具有“福禄双全”的美好寓意,M中不存在的官能团为( ) A、碳氟键 B、碳氯键 C、碳碳双键 D、醛基3. 下列关于生物大分子的叙述中正确的是( )A、糖类、油脂、蛋白质与核酸均为人体所必需的生物大分子 B、淀粉和纤维素在人体内可水解为葡萄糖,为人体活动提供所需的能量 C、蛋白质在重金属盐的作用下发生盐析现象,盐析是一个可逆过程 D、DNA分子中的碱基间通过氢键作用配对以保持双螺旋结构4. 化合物N(如图所示)在热熔胶、粘合剂、橡胶等多行业有广泛应用。下列关于N的说法错误的是( )
)具有“福禄双全”的美好寓意,M中不存在的官能团为( ) A、碳氟键 B、碳氯键 C、碳碳双键 D、醛基3. 下列关于生物大分子的叙述中正确的是( )A、糖类、油脂、蛋白质与核酸均为人体所必需的生物大分子 B、淀粉和纤维素在人体内可水解为葡萄糖,为人体活动提供所需的能量 C、蛋白质在重金属盐的作用下发生盐析现象,盐析是一个可逆过程 D、DNA分子中的碱基间通过氢键作用配对以保持双螺旋结构4. 化合物N(如图所示)在热熔胶、粘合剂、橡胶等多行业有广泛应用。下列关于N的说法错误的是( )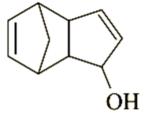 A、分子式为 B、能发生消去反应和还原反应 C、能使酸性高锰酸钾溶液褪色 D、存在遇溶液显色的同分异构体5. 有机化合物分子中基团之间会相互影响,下列叙述没有表现出基团间相互影响的是( )A、苯酚易与NaOH溶液反应,环已醇不与NaOH溶液反应 B、苯酚可以发生加成反应,乙醇不能发生加成反应 C、苯与浓硝酸发生硝化反应生成硝基苯,甲苯与浓硝酸发生硝化反应生成2,4,6-三硝基甲苯 D、甲苯可以使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色6. 有机化合物的定性、定量分析会用到多种化学仪器,下列关于化学仪器的说法错误的是( )A、质谱仪可以确定有机化合物的相对分子质量 B、元素分析仪可以用于测定有机化合物的结构 C、红外光谱仪可以检测有机化合物的官能团 D、核磁共振氢谱仪可以判断有机化合物中不同类型氢原子的相对数目7. 下列能层中包含f能级的是( )A、K层 B、L层 C、M层 D、N层8. 下列表示物质结构的化学用语或模型正确的是( )A、2-甲基-1-丁烯的键线式:
A、分子式为 B、能发生消去反应和还原反应 C、能使酸性高锰酸钾溶液褪色 D、存在遇溶液显色的同分异构体5. 有机化合物分子中基团之间会相互影响,下列叙述没有表现出基团间相互影响的是( )A、苯酚易与NaOH溶液反应,环已醇不与NaOH溶液反应 B、苯酚可以发生加成反应,乙醇不能发生加成反应 C、苯与浓硝酸发生硝化反应生成硝基苯,甲苯与浓硝酸发生硝化反应生成2,4,6-三硝基甲苯 D、甲苯可以使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色6. 有机化合物的定性、定量分析会用到多种化学仪器,下列关于化学仪器的说法错误的是( )A、质谱仪可以确定有机化合物的相对分子质量 B、元素分析仪可以用于测定有机化合物的结构 C、红外光谱仪可以检测有机化合物的官能团 D、核磁共振氢谱仪可以判断有机化合物中不同类型氢原子的相对数目7. 下列能层中包含f能级的是( )A、K层 B、L层 C、M层 D、N层8. 下列表示物质结构的化学用语或模型正确的是( )A、2-甲基-1-丁烯的键线式: B、基态铜原子的价电子排布式:
C、基态氧原子的轨道表示式:
B、基态铜原子的价电子排布式:
C、基态氧原子的轨道表示式: D、铜氨配离子的结构式:
D、铜氨配离子的结构式: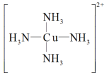 9. 甘氨酸铜是一种配合物,能溶于水,常用于医药、电镀,其结构如图所示。下列关于甘氨酸铜的说法错误的是( )
9. 甘氨酸铜是一种配合物,能溶于水,常用于医药、电镀,其结构如图所示。下列关于甘氨酸铜的说法错误的是( ) A、该配合物呈电中性 B、Cu的化合价为+2 C、配位数为2 D、提供电子对的原子为N、O10. 随着温度的升高,水从固态融化成液态,再蒸发成气态,最终分解成氢气和氧气,如图所示,这个过程中主要克服的作用力依次是( )
A、该配合物呈电中性 B、Cu的化合价为+2 C、配位数为2 D、提供电子对的原子为N、O10. 随着温度的升高,水从固态融化成液态,再蒸发成气态,最终分解成氢气和氧气,如图所示,这个过程中主要克服的作用力依次是( )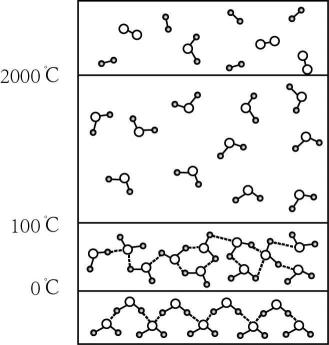 A、分子间作用力 分子间作用力、氢键 极性共价键 B、氢键 氢键、分子间作用力 极性共价键 C、分子间作用力 分子间作用力、氢键 非极性共价键 D、氢键 氢键、分子间作用力 非极性共价键11. 下列实验装置可以达到实验目的的是( )
A、分子间作用力 分子间作用力、氢键 极性共价键 B、氢键 氢键、分子间作用力 极性共价键 C、分子间作用力 分子间作用力、氢键 非极性共价键 D、氢键 氢键、分子间作用力 非极性共价键11. 下列实验装置可以达到实验目的的是( )A
B
C
D




分离苯和甲苯
验证乙酸酸性强于苯酚
制备溴苯
制备并检验乙炔
A、A B、B C、C D、D12. 托瑞米芬是一种抗癌药品,其结构简式如图所示。下列关于托瑞米芬的说法错误的是( ) A、常温下为液体,易溶于水 B、能发生水解反应和消去反应 C、存在顺式结构的同分异构体 D、分子中3个苯环可能共平面13. 有机化合物X与在HCl的催化作用下可反应生成Y,其反应如图:
A、常温下为液体,易溶于水 B、能发生水解反应和消去反应 C、存在顺式结构的同分异构体 D、分子中3个苯环可能共平面13. 有机化合物X与在HCl的催化作用下可反应生成Y,其反应如图:
下列说法正确的是( )
A、分子X与分子Y所含官能团种类相同 B、与HCOOC2H5同类别的同分异构体还有2种 C、该反应的副产物为CH3CH2OH和H2O D、1mol分子X、Y均最多可与5molH2发生加成反应14. 下列分离除杂实验操作能达到实验目的的是( )选项
实验目的
实验操作
A
除去溴苯中的少量溴单质
向溴苯中加入NaOH溶液,振荡,静置后分液
B
除去苯中少量苯酚
向混合物中加入浓溴水,产生白色沉淀后过滤除去沉淀物
C
除去乙烷中的少量乙烯
将混合气体通入高锰酸钾溶液中
D
除去苯甲酸中难溶杂质
将粗苯甲酸在水中溶解,加热,冷却结晶,过滤
A、A B、B C、C D、D15. 下列有关物质结构与性质的说法正确的是( )A、温度升高使金属晶体中自由电子运动速度加快,导电性增强 B、碳化硅的结构类似于金刚石,所以碳化硅具有很高的硬度 C、的沸点低于 , 是由于C=O键的键能比C=S键的大 D、因金属性:K>Na>Mg,所以熔点:16. M、W、X、Y、Z是原子序数依次增大的前四周期元素,其元素性质或基态原子结构如表。元素
元素性质或原子结构
M
宇宙中含量最多的元素
W
价层电子排布是nsnnpn-1
X
最外能层中的最高能级不同轨道均填充有电子,且自旋方向相同
Y
最外层电子数是次外层电子数的一半
Z
+3价阳离子中电子所占据的最高能级处于半充满状态
下列说法错误的是( )
A、原子半径:W>X>M B、电负性:X>Y C、元素W、Y的单质均可做半导体材料 D、Z位于元素周期表的ds区二、非选择题
-
17. 已知A、B、C、D为原子序数依次增大的短周期元素,A的核外电子总数与其周期序数相同;B的基态原子的核外有3个能级,且每个能级上的电子数相等;D的基态原子2p轨道中含有两种不同自旋方向的电子,且电子数之比为3∶1。回答下列问题:(1)、B、C、D的第一电离能由大到小的顺序为(填元素符号)。(2)、简单氢化物的稳定性:CD(填“>”或“<”),原因为.(3)、分子式为ABC的化合物属于(填“极性”或“非极性")分子,其结构中键与键的比例为。(4)、桂皮中含有的肉桂醛(
 )是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中,根据其结构特征,分析预测其可发生如下反应,完成表格。
)是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中,根据其结构特征,分析预测其可发生如下反应,完成表格。序号
参与反应的试剂
反应方程式
反应类型
①
新制的氢氧化铜
②
溴的四氯化碳溶液
18. 苯甲酸乙酯可用于配制香水、香精和人造精油,也大量用于食品中,实验室制备苯甲酸乙酯的原理为: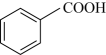 +C2H5OH
+C2H5OH +H2O
+H2O已知:I.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
II.“环己烷-乙醇-水”会形成共沸物(沸点62.6℃),一些有机物的物理性质如表所示。
物质
颜色、状态
沸点(℃)
密度()
溶解性
苯甲酸
无色晶体
249(100℃升华)
1.27
微溶于水,易溶于乙醇、乙醚等有机溶剂
苯甲酸乙酯
无色液体
212.6
1.05
微溶于热水,与乙醇、乙醚混溶
乙醇
无色液体
78.3
0.79
与水互溶
环己烷
无色液体
80.8
0.73
不溶于水
实验装置如图所示(加热及夹持装置已省略),实验步骤如下:

i.在X中加入12.20g苯甲酸、20mL环己烷、5mL浓硫酸和少许碎瓷片,并通过分液漏斗加入60mL(过量)乙醇;
ii.控制温度在65~70℃加热回流2h,期间不时打开旋塞放出分水器中液体;
iii.反应结束后,将X内反应液依次用水、饱和溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
iv.向iii中所得有机层中加入氯化钙,蒸馏,接收210~213℃的馏分,得到产品10.00mL。
请回答下列问题:
(1)、仪器X的名称为;其最适宜规格为(填字母序号)。A.100mL B.150mL C.250mL D.500mL
(2)、冷凝管的进水口为(填“a”或“b”)。(3)、“加热回流”时,装置宜采用的加热方法是 , 判断反应完成的实验现象为。(4)、使用分水器能提高酯的产率,原因是(用平衡移动的原理解释)。(5)、用饱和溶液洗涤反应后的溶液,目的是为了除去。(6)、对水层再用乙醚萃取后合并至有机层的目的是。(7)、本实验得到的苯甲酸乙酯的产率为。19. 氟(F)、氯(Cl)属于卤素,它们在自然界都以典型的盐类存在,是典型成盐元素。(1)、基态氟原子的轨道表示式为 , 其处于最高能级的电子云轮廓图为。(2)、三氟化氮()和三氯化氮()是两种强氧化剂。①中N原子的杂化轨道类型为 , 分子的空间构型为。
②的键角小于的原因为。
(3)、是一种重要的化工原料,的VSEPR模型为。(4)、氟化钙和氯化钙均为离子晶体,其中氟化钙的立方晶胞图如图所示。已知氟化钙晶胞参数为a pm,表示阿伏加德罗常数的值。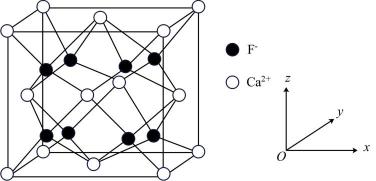
①每个氟化钙晶胞中含有的数目为个;离子晶体中离子的配位数是指一个离子周围最近的异电性离子的数目,则的配位数为。
②以“
 ”表示 , “
”表示 , “ ”表示 , 画出氟化钙晶胞沿z轴方向投影图。
”表示 , 画出氟化钙晶胞沿z轴方向投影图。③氟化钙的密度为(列出计算式)。
20. 聚合物H(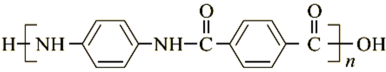 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如图:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如图:
已知:
 。(1)、合成路线中生成A的反应中需要加入的试剂和反应条件分别为。(2)、M的结构简式为;C的名称为。(3)、用“*”标出B分子中的手性碳原子。(4)、E→F的化学方程式为。(5)、写出满足下列条件的D的一种同分异构体结构简式。
。(1)、合成路线中生成A的反应中需要加入的试剂和反应条件分别为。(2)、M的结构简式为;C的名称为。(3)、用“*”标出B分子中的手性碳原子。(4)、E→F的化学方程式为。(5)、写出满足下列条件的D的一种同分异构体结构简式。i.既能发生银镜反应又能发生水解反应;
ii.水解产物遇溶液显紫色;
ili.核磁共振氢谱显示的峰面积之比为1∶2∶2∶1。
(6)、请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂,合成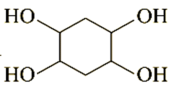 , 写出合成路线。(示例:AB)
, 写出合成路线。(示例:AB)