广东省湛江市2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 第24届冬奥会于2022年2月4日在北京开幕,以下事实对应的解释或说法错误的是( )A、有舵雪橇中的碳纤维是一种有机高分子材料 B、吉祥物“冰墩墩”采用聚氯乙烯等原材料制作,聚氯乙烯不能使溴水褪色 C、冬奥会采用氢燃料电池车,还开发了全新车载光伏发电系统,体现了“绿色出行”的理念 D、北京冬奥会使用二氧化碳跨临界制冰机组,与传统制冷剂氟利昂相比更加环保2. 下列说法错误的是( )A、棉、麻、丝充分燃烧都会产生二氧化碳和水 B、疫苗等生物制剂需要在低温下保存 C、饱和硫酸钠溶液可用于提纯蛋白质 D、木糖醇是一种常见的甜味剂,与葡萄糖类似,属于单糖3. 某元素价离子的电子排布式为 , 该元素在周期表中的位置和区域是( )A、第三周期第ⅡA族;P区 B、第三周期第Ⅷ族;d区 C、第四周期第ⅡA族;s区 D、第四周期第Ⅷ族;ds区4. 下列关于晶体的叙述中,正确的是( )A、在晶体中只要有阳离子就一定有阴离子 B、晶体中分子间作用力越大,分子越稳定 C、HI的相对分子质量大于HF,所以HI的沸点高于HF D、金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子5. 下列说法正确的是( )A、碳原子之间以单键结合,碳原子剩余的价键全部与氢原子结合的有机物一定是饱和链烃 B、几种苯的同系物沸点由高到低的顺序为:邻二甲苯>间二甲苯>对二甲苯 C、的一氯代物有3种 D、石油的分馏、裂化和煤的干馏都是化学变化6. 下列反应中前者属于取代反应,后者属于加成反应的是( )A、甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 B、苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成;乙烯与水生成乙醇的反应 C、乙烯与溴的四氯化碳溶液反应;溴乙烷在NaOH水溶液中加热发生的反应 D、在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应7. 设阿伏加德罗常数的值为。下列说法正确的是( )A、60g和12g金刚石中各含有4个键和4个键 B、含4.8g碳元素的石墨晶体中的共价键数为1.2个 C、2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2 D、0.5mol乙酸乙酯在酸性条件下水解,生成乙醇的分子数为1.08. 有机物虽然种类繁多,但其命名是有规则的。下列有机物的命名正确的是( )A、
 1,3,5-三溴苯酚
B、
1,3,5-三溴苯酚
B、 2-丁醇
C、
2-丁醇
C、 3-甲基丁烯
D、
3-甲基丁烯
D、 2,6-二甲基-5-乙基庚烷
9. 下列说法正确的是( )A、中两个氯原子形成共价键,轨道重叠示意图为
2,6-二甲基-5-乙基庚烷
9. 下列说法正确的是( )A、中两个氯原子形成共价键,轨道重叠示意图为 B、某原子核外电子由 , 原子放出能量
C、具有下列最外层电子排布式的原子中,①、②、③、④ , 第一电离能最大的是③
D、空间充填模型
B、某原子核外电子由 , 原子放出能量
C、具有下列最外层电子排布式的原子中,①、②、③、④ , 第一电离能最大的是③
D、空间充填模型 可以表示甲烷分子,也可以表示四氯化碳分子
10. 下列说法正确的是( )A、甘油()分子中含有1个手性碳原子 B、元素的电负性越大,非金属性越强,第一电离能也越大 C、键的极性: D、中键角比中键角大11. 关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是( )A、配位体是Cl-和H2O,配位数是8 B、中心离子是Ti4+ , 配离子是[TiCl(H2O)5]2+ C、内界和外界中的Cl-的数目比是1:2 D、在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀12. 下列对有关事实的解释正确的是( )
可以表示甲烷分子,也可以表示四氯化碳分子
10. 下列说法正确的是( )A、甘油()分子中含有1个手性碳原子 B、元素的电负性越大,非金属性越强,第一电离能也越大 C、键的极性: D、中键角比中键角大11. 关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是( )A、配位体是Cl-和H2O,配位数是8 B、中心离子是Ti4+ , 配离子是[TiCl(H2O)5]2+ C、内界和外界中的Cl-的数目比是1:2 D、在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀12. 下列对有关事实的解释正确的是( )选项
事实
解释
A
NH3的热稳定性比PH3强
NH3分子间能形成氢键
B
基态Fe3+比Fe2+稳定
基态Fe3+价电子排布式为3d5 , 是半充满的稳定结构
C
石墨能够导电
石墨是离子晶体
D
CH4与H2O分子的空间构型不同
它们中心原子杂化轨道类型不同
A、A B、B C、C D、D13. 关于下式表示的有机物的性质叙述中错误的是( ) A、它有酸性,能与纯碱溶液反应 B、它可以水解,水解产物只有一种 C、1 mol该有机物最多能和7 mol NaOH反应 D、该有机物能发生取代反应14. 下表中的实验操作或实验现象能达到实验目的或得出相应结论的是( )
A、它有酸性,能与纯碱溶液反应 B、它可以水解,水解产物只有一种 C、1 mol该有机物最多能和7 mol NaOH反应 D、该有机物能发生取代反应14. 下表中的实验操作或实验现象能达到实验目的或得出相应结论的是( )选项
实验操作或实验现象
实验目的或结论
A
取4mL淀粉溶液,加入5mL稀硫酸,加热5min后,再加入少量新制的悬浊液,加热至沸腾,没有出现砖红色沉淀
淀粉未水解
B
取少量与NaOH溶液共热,待溶液不分层后,再滴加溶液
检验中的溴元素
C
向氯化亚铁溶液中滴加酸性高锰酸钾溶液
检验溶液中的
D
向苯酚浊液中滴加溶液,浊液变澄清
结合的能力比强
A、A B、B C、C D、D15. 用价层电子对互斥理论(VSEPR)预测H2S和COCl2的立体结构,两个结论都正确的是( )A、直线形;三角锥形 B、V形;三角锥形 C、直线形;平面三角形 D、V形;平面三角形16. 已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( ) A、电负性: B、简单离子半径: C、元素W形成的某阳离子空间构型为正四面体 D、化合物中含有极性共价键和非极性共价键
A、电负性: B、简单离子半径: C、元素W形成的某阳离子空间构型为正四面体 D、化合物中含有极性共价键和非极性共价键二、非选择题
-
17. 完成下列化学用语。(1)、Mn原子的电子排布式:。(2)、的离子结构示意图为。(3)、Co的价电子排布图为。(4)、
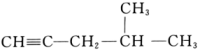 系统命名:。 (5)、4,4-二甲基-2-戊醇的结构简式为。(6)、
系统命名:。 (5)、4,4-二甲基-2-戊醇的结构简式为。(6)、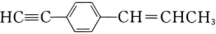 分子中最多有个原子在同一平面内。 18. 乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
分子中最多有个原子在同一平面内。 18. 乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
实验过程:在50mL两口烧瓶中加入6.9g水杨酸、10mL醋酸酐,充分溶解。通过a缓慢滴加0.5mL浓硫酸后加热,维持烧瓶内温度在70℃左右,充分反应。稍冷后进行如下操作。

①在不断搅拌下将反应后的混合物倒入100mL冷水中,析出固体,过滤。
②所得结晶粗品加入50mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4g。
已知:
水杨酸
醋酸酐
乙酰水杨酸
熔点/℃
157~159
135~138
密度/()
1.44
1.10
1.35
相对分子质量
138
102
180
回答下列问题:
(1)、仪器b的名称为 , 作用是。(2)、该合成反应中宜采用____(填标号)加热。A、水浴 B、酒精灯 C、煤气灯 D、电炉(3)、在实验过程中,两口烧瓶中除加入水杨酸、醋酸酐和浓硫酸外还需加入 , 作用是。(4)、①中需使用冷水,目的是。(5)、②中饱和碳酸氢钠的作用是 , 以便过滤除去难溶杂质。(6)、④采用的纯化方法为。(7)、本实验的产率是%。19. 第ⅢA族元素有着广泛的应用,B可用作特种玻璃,Al可用作火箭和飞机外壳,Ga可用作半导体材料,In可用于电子仪器中,Tl可用于红外技术。回答下列问题:(1)、基态Ga原子有种不同运动状态的电子,分子中B原子的杂化类型为。(2)、、熔点分别为1290℃和192℃,熔点呈现如此变化的原因是。(3)、正硼酸()是一种片层状结构的白色晶体,层内的分子通过氢键相连(如图所示)。
1mol的晶体中有mol氢键。
(4)、铜与氧元素形成的晶胞如下图所示。回答下列问题。
①晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为、 , 则d的坐标参数为。
②已知该晶体的密度为 , 是阿伏加德罗常数的值,则晶胞参数为cm(列出计算式即可)。
20. 新泽茉莉醛是一种名贵的香料,其合成路线如下:
已知:①RCHO+R′CH2CHO
 +H2O
+H2O②RCHO+

 +H2O(1)、已知甲的相对分子质量为30,甲的名称为。(2)、写出反应①的化学方程式:。(3)、D中含氧官能团的名称是。(4)、写出E的结构简式:。(5)、芳香族化合物G与E互为同分异构体,1molG能与足量溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与乙二醇反应生成高分子化合物,写出该高分子化合物的结构简式:。(6)、结合已知①,设计以乙醇和苯甲醛(
+H2O(1)、已知甲的相对分子质量为30,甲的名称为。(2)、写出反应①的化学方程式:。(3)、D中含氧官能团的名称是。(4)、写出E的结构简式:。(5)、芳香族化合物G与E互为同分异构体,1molG能与足量溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与乙二醇反应生成高分子化合物,写出该高分子化合物的结构简式:。(6)、结合已知①,设计以乙醇和苯甲醛( )为原料(无机试剂任选)制备
)为原料(无机试剂任选)制备 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):。