广东省梅州市2021-2022学年高二下学期期末联考化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 2022年北京冬奥会已经成功落下帷幕,它的成功举办离不开各种科技力量的支撑。下列说法错误的是( )A、速滑竞赛服采用的聚氨酯材料是一种有机高分子材料 B、被称为“冰丝带”的国家速滑馆采用了二氧化碳制冰技术,二氧化碳是极性分子 C、冬奥会用紫外杀菌技术对手机和笔记本电脑等进行消毒,是利用紫外线使蛋白质变性 D、核酸检测是确认是否感染新冠病毒的有效手段,核苷酸缩合聚合可以得到核酸2. 企炉饼是梅县区松口镇的特产之一,也是老一辈客家人关于下南洋的回忆,其制作原料主要有面粉、橙糖、白芝麻、白砂糖、黑芝麻、油脂等。下列有关说法正确的是( )A、面粉的主要成分为淀粉 B、糖类都能水解 C、油脂属于高分子化合物 D、烘烤企炉饼过程发生的是物理变化3. 下列化学用语的表达错误的是( )A、2-甲基丁烷又称为异戊烷 B、乙酸的结构简式: C、葡萄糖的实验式: D、苯分子的空间填充模型:
 4. 下列关于原子结构与元素周期表的说法错误的是( )A、“电子云”中的小黑点描述的是电子在原子核外空间出现的概率密度 B、某基态原子的价电子排布式为 , 则该元素位于周期表第四周期第ⅢA族 C、表示3p能级有2个轨道 D、焰色试验是与原子核外电子跃迁有关的物理现象5. 下列晶体分类正确的是( )
4. 下列关于原子结构与元素周期表的说法错误的是( )A、“电子云”中的小黑点描述的是电子在原子核外空间出现的概率密度 B、某基态原子的价电子排布式为 , 则该元素位于周期表第四周期第ⅢA族 C、表示3p能级有2个轨道 D、焰色试验是与原子核外电子跃迁有关的物理现象5. 下列晶体分类正确的是( )选项
分子晶体
共价晶体
金属晶体
离子晶体
A
普通玻璃
金刚石
Cu
B
S
Si
Hg
C
Ar
Fe
D
Ag
A、A B、B C、C D、D6. 下列说法错误的是( )A、利用超分子的分子识别特征,可以用“杯酚”和甲苯、氯仿等分离和 B、某元素气态基态原子的逐级电离能()分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是 C、晶体与非晶体的本质区别是有无固定熔点 D、的分子立体构型为 , 由此可知为极性分子
7. 配合物种类繁多,在分析化学、工业生产以及生物学中有广泛应用。已知某配合物的化学式为 , 下列有关说法正确的是( )A、配体是和 , 配位数是9 B、该配合物中提供孤电子对的是中心离子 C、该配合物中存在离子键、配位键和极性键 D、向其溶液中加入足量溶液,所有都能转化为沉淀8. 下列变化规律正确的是( )A、微粒半径: B、碳碳键键长:碳碳单键<碳碳双键<碳碳三键 C、硬度:金刚石<碳化硅<硅 D、键角:9. 下列实验不能达到实验目的的是( )
, 由此可知为极性分子
7. 配合物种类繁多,在分析化学、工业生产以及生物学中有广泛应用。已知某配合物的化学式为 , 下列有关说法正确的是( )A、配体是和 , 配位数是9 B、该配合物中提供孤电子对的是中心离子 C、该配合物中存在离子键、配位键和极性键 D、向其溶液中加入足量溶液,所有都能转化为沉淀8. 下列变化规律正确的是( )A、微粒半径: B、碳碳键键长:碳碳单键<碳碳双键<碳碳三键 C、硬度:金刚石<碳化硅<硅 D、键角:9. 下列实验不能达到实验目的的是( )

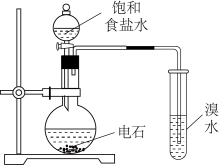

A.制备并接收乙酸乙酯
B.检验1-溴丁烷的消去产物
C.证明乙炔可使溴水褪色
D.鉴别乙醇和乙醚
A、A B、B C、C D、D10. Y是合成一种治疗帕金森症药品的反应中间体,合成Y的反应见下图。下列说法正确的是( ) A、1molX最多能与反应 B、用溴水能鉴别X和Y C、X分子中所有碳原子不可能处于同一平面 D、Y能发生氧化反应、加成反应、取代反应、消去反应11. 将2.3g有机物在氧气中完全燃烧,生成和 , 测得其质谱和核磁共振氢谱如图所示,核磁共振氢谱中3组吸收锋面积之比为1:2:3。
A、1molX最多能与反应 B、用溴水能鉴别X和Y C、X分子中所有碳原子不可能处于同一平面 D、Y能发生氧化反应、加成反应、取代反应、消去反应11. 将2.3g有机物在氧气中完全燃烧,生成和 , 测得其质谱和核磁共振氢谱如图所示,核磁共振氢谱中3组吸收锋面积之比为1:2:3。
下列说法正确的是( )
A、该有机物的相对分子质量为31 B、该有机物可用于提取碘水中的碘 C、1mol该有机物含有的键数目为 D、该有机物的同系物在水中的溶解度随着碳原子数的增多而增大12. 下列实验操作和现象以及所得结论均正确的是( )选项
实验操作和现象
结论
A
苯不能使酸性高锰酸钾溶液褪色,而甲苯能使酸性高锰酸钾溶液褪色
苯环使得甲基活化
B
在溴乙烷中加入氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银溶液,有不溶于水的沉淀析出
溴乙烷在碱性条件下能水解
C
向苯酚浊液中滴加溶液,浊液变澄清
苯酚的酸性强于的酸性
D
将乙醇与浓硫酸的混合物加热至170℃,并将产生的气体通入少量酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色
乙醇发生了消去反应
A、A B、B C、C D、D13. 制备重要的有机合成中间体I的反应如图所示。下列说法正确的是( ) A、该反应属于取代反应 B、可用少量酸性高锰酸钾溶液鉴别苯甲醛和2-环己烯酮 C、中间体I的一氯代物有10种 D、中间体I分子中含有1个手性碳原子14. “类推”是一种重要的学习方法,但有时会产生不符合题意,下列类推得到的结论正确的是( )A、离子晶体中一定有离子键,分子晶体中也一定有共价键 B、是直线形分子,则也是直线形分子 C、极易溶于水,也极易溶于水 D、中的N原子是杂化,中的B原子也是杂化15. 下列两组命题中,M组命题能用N组命题加以解释的是( )
A、该反应属于取代反应 B、可用少量酸性高锰酸钾溶液鉴别苯甲醛和2-环己烯酮 C、中间体I的一氯代物有10种 D、中间体I分子中含有1个手性碳原子14. “类推”是一种重要的学习方法,但有时会产生不符合题意,下列类推得到的结论正确的是( )A、离子晶体中一定有离子键,分子晶体中也一定有共价键 B、是直线形分子,则也是直线形分子 C、极易溶于水,也极易溶于水 D、中的N原子是杂化,中的B原子也是杂化15. 下列两组命题中,M组命题能用N组命题加以解释的是( )选项
M组
N组
A
酸性强弱:三氟乙酸>三氯乙酸
F的电负性大于Cl的电负性,导致三氟乙酸羧基中的羟基的极性更大
B
 的沸点高于
的沸点高于
因为
 分子间范德华力更大
分子间范德华力更大C
的稳定性大于
的分子间作用力更大
D
HI的沸点比HCl的高
H-I键的键能大于H-Cl键的键能
A、A B、B C、C D、D16. 下图为几种物质晶体或晶胞结构示意图。
下列说法错误的是( )
A、1mol冰晶体中可含有2mol氢键 B、碘晶体属于分子晶体,每个碘晶胞中实际占有4个碘原子 C、金刚石、MgO、碘单质熔点:金刚石>MgO>碘单质 D、MeO晶胞中b坐标参数为(1,1,0),则c坐标参数为二、综合题
-
17. 是环境友好材料,能光催化降解有机物。回答下列问题:(1)、基态Ti原子核外电子占据的最高能层符号为 , 占据该能层电子的电子云形状是 , 价电子中未成对电子个数为。(2)、纳米催化处理污水的一个实例如图所示。
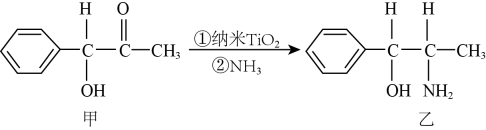
化合物甲的分子中采取杂化方式的碳原子个数为 , 化合物乙中C、N、O元素的第一电离能由大到小的顺序是。
(3)、香豆素(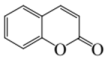 )是一种天然香料,能被光降解,香豆素的分子式为 , 写出在加热条件下其与足量NaOH溶液反应的化学方程式。 18. 1-溴丁烷主要用于生产染料和香料。实验室可通过正丁醇()、溴化钠和浓硫酸共同反应制得,除产物1-溴丁烷外,还有副产物1-丁烯、正丁醚等。
)是一种天然香料,能被光降解,香豆素的分子式为 , 写出在加热条件下其与足量NaOH溶液反应的化学方程式。 18. 1-溴丁烷主要用于生产染料和香料。实验室可通过正丁醇()、溴化钠和浓硫酸共同反应制得,除产物1-溴丁烷外,还有副产物1-丁烯、正丁醚等。名称
相对分子质量
沸点/℃
密度
溶解性
正丁醇
74
117.7
0.80
微溶于水,易溶于浓硫酸及有机溶剂
1-溴丁烷
137
101.6
1.28
不溶于水,易溶于醇、醚等有机溶剂
正丁醚
130
142.2
0.77
不溶于水,易溶于浓硫酸及有机溶剂
实验步骤:
(一)1-溴丁烷的合成:在10mL三颈烧瓶中,加入2.60g(约0.025mol)研细的溴化钠、1.85mL正丁醇并放入一粒搅拌子,安装好装置(如图)。加入事先混合的2.80mL浓硫酸和2.00mL水的混合液,搅拌,硅油浴回流 , 反应完毕,稍冷却后,改成蒸馏装置,蒸出粗产物。
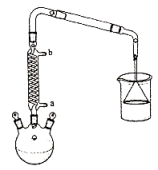
(二)粗产物提纯:将馏出液依次用水、浓硫酸、水、饱和碳酸氢钠溶液及水洗涤并分离,然后再用无水氯化钙干燥。再将干燥好的液体转入干燥的蒸馏烧瓶中,加热,收集99℃~102℃的馏分,得到1-溴丁烷1.15mL。
回答下列问题:
(1)、在三颈烧瓶中生成1-溴丁烷的反应可分为两步:①;写出第②步反应的化学方程式 , 该步的反应类型是。(2)、上图中冷凝管的作用是 , 其进水口是(填“a”或“b”)。(3)、合成1-溴丁烷时,为了防止反应中生成的HBr挥发,烧杯中盛放作吸收剂(填字母序号)。A.二硫化碳 B.浓盐酸 C.四氯化碳 D.氢氧化钠溶液(4)、洗涤粗产物时,要用到的玻璃仪器主要有烧杯和分液漏斗,洗涤后进行分离操作,该分离操作的名称是 , 加入浓硫酸洗涤的目的是。(5)、不同的物料比对1-溴丁烷产量有影响,如果反应开始时多增加1.00mL浓硫酸,其余实验条件不变,测得1-溴丁烷的产量是0.80mL,产量减小可能的原因是(答一点即可)。19. 磷及其化合物在工业生产中起着重要的作用。(1)、基态磷原子价电子的轨道表示式为。(2)、磷有多种同素异形体。①白磷()是分子晶体,易溶于 , 难溶于水,说明白磷和都是分子(填“极性”或“非极性”)。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如图所示。
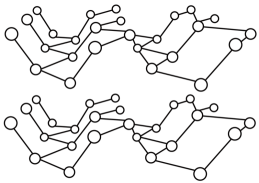
下列有关黑磷晶体的说法正确的是(填字母序号)
A.黑磷晶体中层与层之间的作用力是分子间作用力
B.黑磷晶体中磷原子杂化方式为杂化
C.黑磷晶体是混合型晶体
D.黑磷晶体的每一层中磷原子都在同一平面上
(3)、是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子(该晶体的晶胞如图所示),写出熔融时的电离方程式。 (4)、与水会形成黄色的配离子 , 为避免颜色干扰,常在含溶液中加入形成无色的。由此推测与形成的配离子更稳定的配体是 , 该配体的空间构型是。(5)、贵金属磷化物(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示。已知晶胞参数为 , 晶体中与P距离最近的Rh的数目为 , 晶体的密度为(列出计算式)。
(4)、与水会形成黄色的配离子 , 为避免颜色干扰,常在含溶液中加入形成无色的。由此推测与形成的配离子更稳定的配体是 , 该配体的空间构型是。(5)、贵金属磷化物(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示。已知晶胞参数为 , 晶体中与P距离最近的Rh的数目为 , 晶体的密度为(列出计算式)。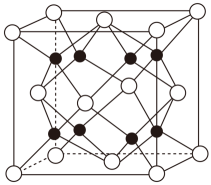 20. 3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由气体A制备该物质的合成路线如图:
20. 3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由气体A制备该物质的合成路线如图:
已知: R-CHO+R’-CH2-CHO


请回答下列问题:
(1)、气体A对氢气的相对密度为14,其化学名称是;I中含氧官能团的名称为。(2)、D的结构简式为。(3)、写出F与银氨溶液反应的化学方程式。(4)、芳香族化合物X是H的同分异构体,1molX与足量溶液反应可生成 , 符合条件的X有种,其中核磁共振氢谱的峰面积比为3:2:2:1的结构简式为(写出其中一种)。(5)、呋喃丙烯酸( )是一种医治血吸虫病的药物呋喃丙胺的原料。请设计以
)是一种医治血吸虫病的药物呋喃丙胺的原料。请设计以 、为原料制备呋喃丙烯酸的合成路线(无机试剂任选)。
、为原料制备呋喃丙烯酸的合成路线(无机试剂任选)。