广东省广州市番禺区2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 下列化学用语或图示表达正确的是( )A、乙炔的结构简式:CHCH B、顺-2-丁烯的球棍模型:
 C、乙烯的空间填充模型:
C、乙烯的空间填充模型: D、聚丙烯的结构简式:
D、聚丙烯的结构简式: 2. 下列说法正确的是( )A、第24届冬奥会中用到的“战袍”利用微信小程序,调控石墨烯片加热保暖,石墨烯和碳纳米管互为同分异构体 B、将煤隔绝空气加强热使之分解的过程,称为煤的干馏,属于化学变化 C、石油减压蒸馏可以获得乙烯 D、碳纤维材料操纵棒是宇航员的手臂“延长器”,碳纤维属于有机高分子材料3. 下列说法错误的是( )A、地沟油变废为宝是实现资源再利用的正要研究课题,地沟油和石蜡油的化学成分相同 B、光照和的混合气体,一段时间后,颜色变浅 C、核酸检测是确认病毒类型的有效手段,核苷酸缩合聚合可以得到核酸 D、“新冠”疫苗需冷藏储运,这与蛋白质变性有关4. 为完成下列各组实验,所选试剂准确、完整的是( )
2. 下列说法正确的是( )A、第24届冬奥会中用到的“战袍”利用微信小程序,调控石墨烯片加热保暖,石墨烯和碳纳米管互为同分异构体 B、将煤隔绝空气加强热使之分解的过程,称为煤的干馏,属于化学变化 C、石油减压蒸馏可以获得乙烯 D、碳纤维材料操纵棒是宇航员的手臂“延长器”,碳纤维属于有机高分子材料3. 下列说法错误的是( )A、地沟油变废为宝是实现资源再利用的正要研究课题,地沟油和石蜡油的化学成分相同 B、光照和的混合气体,一段时间后,颜色变浅 C、核酸检测是确认病毒类型的有效手段,核苷酸缩合聚合可以得到核酸 D、“新冠”疫苗需冷藏储运,这与蛋白质变性有关4. 为完成下列各组实验,所选试剂准确、完整的是( )实验目的
试剂
A
除去苯中少量的苯酚
浓溴水
B
验证蔗糖水解产生还原性糖
蔗糖溶液、稀硫酸、蒸馏水、pH试纸、新制氢氧化铜悬浊液
C
实验室制备乙烯
浓硫酸、乙醇、碎瓷片
D
检验中的溴元素
NaOH溶液、溶液
A、A B、B C、C D、D5. 我国率先突破从二氧化碳到淀粉的人工合成,我国二氧化碳合成淀粉的颠覆性技术有助于未来实现“碳中和”。下列相关说法错误的是( )A、是一种温室气体 B、合成过程中,用到的“酶”起到了至关重要的催化作用 C、淀粉属于纯净物 D、淀粉属于多糖6. 下列各原子或离子的说法正确的是( )A、的电子排布式: B、S的原子结构示意图: C、该电子排布图
C、该电子排布图 违背了泡利原理
D、的电子式:
违背了泡利原理
D、的电子式: 7. 已知配合物[Cr(NH3)4Cl2]Cl易溶于水,下列说法正确的是( )A、配位数为6,配位原子为N、Cl B、1mol该配合物在水中可电离出3molCl- C、配合物中Cr为+1价 D、配离子中含有离子键、配位键、普通共价键8. 我国科学家以NiO−Al2O3/Pt为催化剂揭示了氨硼烷产生的机理。氨硼烷结构见下图,下列说法正确的是( )
7. 已知配合物[Cr(NH3)4Cl2]Cl易溶于水,下列说法正确的是( )A、配位数为6,配位原子为N、Cl B、1mol该配合物在水中可电离出3molCl- C、配合物中Cr为+1价 D、配离子中含有离子键、配位键、普通共价键8. 我国科学家以NiO−Al2O3/Pt为催化剂揭示了氨硼烷产生的机理。氨硼烷结构见下图,下列说法正确的是( ) A、1mol氨硼烷分子含6molσ键 B、基态Ni原子价层电子排布式为 C、N元素基态原子的轨道表示式:
A、1mol氨硼烷分子含6molσ键 B、基态Ni原子价层电子排布式为 C、N元素基态原子的轨道表示式: D、氨硼烷所有的原子均达到8电子稳定结构
9. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的2p能级上未成对电子数是同周期中最多的,Y元素原子最外层电子数是内层电子数的3倍,Z元素的焰色反应为黄色,W是地壳中含量最多的金属元素。下列说法正确的是( )A、原子半径:r(Z)>r(Y)>r(X) B、第一电离能:I1(X)>I1(Y)>I1(W) C、最高价氧化物对应水化物的碱性:W>Z D、Y的氢化物的沸点在同族元素氢化物中最低10. 三氯化氮 (NCl3)常温下是一种淡黄色的液体,其分子结构呈三角锥形。以下关于的说法正确的是( )A、分子中的N原子为杂化 B、分子中不存在孤电子对 C、它的沸点比的沸点低 D、因的键能大,所以的沸点高11. 用分子结构知识推测下列说法正确的是( )A、与分子均呈V形 B、乙炔分子中碳原子采取sp杂化,分子中键与键的数目之比为3∶2 C、与的VSEPR模型均为正四面体形 D、与分子中均含有键,均能发生加成反应12. 下列对有关事实的解释正确的是( )
D、氨硼烷所有的原子均达到8电子稳定结构
9. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的2p能级上未成对电子数是同周期中最多的,Y元素原子最外层电子数是内层电子数的3倍,Z元素的焰色反应为黄色,W是地壳中含量最多的金属元素。下列说法正确的是( )A、原子半径:r(Z)>r(Y)>r(X) B、第一电离能:I1(X)>I1(Y)>I1(W) C、最高价氧化物对应水化物的碱性:W>Z D、Y的氢化物的沸点在同族元素氢化物中最低10. 三氯化氮 (NCl3)常温下是一种淡黄色的液体,其分子结构呈三角锥形。以下关于的说法正确的是( )A、分子中的N原子为杂化 B、分子中不存在孤电子对 C、它的沸点比的沸点低 D、因的键能大,所以的沸点高11. 用分子结构知识推测下列说法正确的是( )A、与分子均呈V形 B、乙炔分子中碳原子采取sp杂化,分子中键与键的数目之比为3∶2 C、与的VSEPR模型均为正四面体形 D、与分子中均含有键,均能发生加成反应12. 下列对有关事实的解释正确的是( )事实
解释
A
石墨晶体中横向与纵向的导电性不同
晶体性质表现自范性
B
CH4与NH3分子的空间构型不同
二者中心原子杂化轨道类型不同
C
H2O的热稳定性比H2S强
H2O分子间形成氢键,而H2S分子间没有形成氢键
D
向盛有硫酸铜蓝色溶液的试管里加入过量氨水,得到深蓝色溶液
NH3与Cu2+间的配位键比H2O与Cu2+间的配位键强
A、A B、B C、C D、D13. 如图为几种晶体或晶胞的结构示意图。
下列说法错误的是( )
A、18g冰晶体中含有2mol氢键 B、在金刚石晶体中,碳原子与碳碳键个数的比为1∶2 C、碘单质是分子晶体,碘单质在中比水中溶解度更大 D、金刚石、MgO、碘单质三种晶体的熔点顺序为:MgO>金刚石>碘单质14. 下列实验用酸性 溶液不能达到预期目的的是( )A、鉴别乙烯和乙烷 B、鉴别四氯乙烯和聚四氟乙烯 C、鉴别苯和对二甲苯 D、检验 中含碳碳双键15. 甲氧苄啶是一种广谱抗菌药,其合成路线中的一步反应如下。下列说法错误的是( ) A、1mol X最多能跟发生加成反应 B、Y在碱性条件下能够水解,生成乙酸 C、Z可发生加成反应、取代反应、氧化反应 D、X在加热条件下,能跟银氨溶液发生反应16. 药物帕罗西汀(Ⅰ)及其合成中间体(Ⅱ)的结构简式如图所示。下列说法错误的是( )
A、1mol X最多能跟发生加成反应 B、Y在碱性条件下能够水解,生成乙酸 C、Z可发生加成反应、取代反应、氧化反应 D、X在加热条件下,能跟银氨溶液发生反应16. 药物帕罗西汀(Ⅰ)及其合成中间体(Ⅱ)的结构简式如图所示。下列说法错误的是( ) A、Ⅰ分子中含有醚键 B、Ⅰ分子中最多只有2个氧原子共平面 C、Ⅱ分子式为C16H18NO4F D、Ⅱ分子中含两个手性碳原子
A、Ⅰ分子中含有醚键 B、Ⅰ分子中最多只有2个氧原子共平面 C、Ⅱ分子式为C16H18NO4F D、Ⅱ分子中含两个手性碳原子二、综合题
-
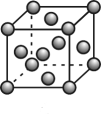
17. 铜及其化合物应用广泛。请回答下列问题:(1)、铜的晶胞结构如图,铜原子的配位数为 , 一个金属铜晶胞中所含的铜原子数为;基态铜原子的价电子排布式为。
 (2)、硫酸铜晶体俗称蓝矾、胆矾,具有催吐、解毒作用,同时也是一种重要的化工原料,具有十分广泛的作用。的空间构型为 , 其中心原子的杂化类型是。(3)、不溶于水,但可溶于浓氨水,反应的化学方程式为:。
(2)、硫酸铜晶体俗称蓝矾、胆矾,具有催吐、解毒作用,同时也是一种重要的化工原料,具有十分广泛的作用。的空间构型为 , 其中心原子的杂化类型是。(3)、不溶于水,但可溶于浓氨水,反应的化学方程式为:。①氨水中的微粒存在的化学键有(填标号)。
A.极性键 B.非极性键 C.氢键 D.键 E.键
②中配体是 , 所含元素中电负性最大的非金属元素是 (填元素符号)。
③中含mol 键。
(4)、的熔点比高的原因是。18. ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、基态O原子电子占据最高能级的电子云轮廓图为形。(2)、S单质的常见形式为 , 其环状结构如图所示,S原子的杂化轨道类型是。 (3)、基态Se原子的核外电子排布式为。(4)、S、Se、Te三种元素电负性由大到小的顺序是 , 三种元素氢化物水溶液的酸性最强的是(填化学式)。(5)、的电子式是 , 常温下是气体而是液体的原因是。(6)、ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有个。晶胞棱长为a pm,密度为(表示阿伏加德罗常数的值)。
(3)、基态Se原子的核外电子排布式为。(4)、S、Se、Te三种元素电负性由大到小的顺序是 , 三种元素氢化物水溶液的酸性最强的是(填化学式)。(5)、的电子式是 , 常温下是气体而是液体的原因是。(6)、ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有个。晶胞棱长为a pm,密度为(表示阿伏加德罗常数的值)。 19. 苯乙腈是一种重要的精细化工产品,主要用于农药、医药、染料和香料中间体的生产。相关科研机构对苯乙腈的生成方法提出改进,使其生产效率进一步提高,同时降低了反应中有毒物质的逸出。相关物质性质:
19. 苯乙腈是一种重要的精细化工产品,主要用于农药、医药、染料和香料中间体的生产。相关科研机构对苯乙腈的生成方法提出改进,使其生产效率进一步提高,同时降低了反应中有毒物质的逸出。相关物质性质:物质名称
相对分子质量
颜色、状态
溶解性
沸点/℃
毒性
苯乙腈
117
无色油状液体,密度比水大
难溶于水,溶于醇
233.5
有毒,受热易分解产生有毒气体
氯化苄
126.5
无色或微黄色的透明液体
微溶于水,混溶于乙醇
179.4
有毒
氰化钠
49
白色结晶颗粒或粉末
易溶于水
1496
剧毒
二甲胺
45
无色气体,高浓度时有类似氨的气味
易溶于水,溶于乙醇
6.9
有毒
反应原理:
 (氯化苄)+NaCN
(氯化苄)+NaCN  (苯以腈)+NaCl
(苯以腈)+NaCl主要装置:

实验步骤:①向仪器a中加入氯化苄25.3g,缓慢加入适量二甲胺水溶液,放入磁子搅拌。
②安装好球形冷凝管、恒压漏斗及温度计,开启冷凝水,并对仪器a进行加热至90℃。
③向恒压漏斗中加入30%氰化钠水溶液49.0g。
④控制滴加速度与反应温度,使反应在90±5℃下进行。
⑤滴加结束后,加热回流20小时。
⑥反应结束并冷却至室温后,向混合物中加100mL水,洗涤,分液。
⑦往得到的粗产品中加入无水颗粒,静置片刻,倒入蒸馏烧瓶中,弃去 , 进行减压(2700Pa)蒸馏,收集115~125℃馏分,得到产品无色透明液体22.3g。
回答下列问题:
(1)、图中仪器a的名称是 , 仪器d的作用是。(2)、进行分液操作时产品在混合物(填“上层”或“下层”)。(3)、无水颗粒的作用是。(4)、在蒸馏过程中,减压蒸馏得到的产品纯度和产率均比常压下蒸馏收集233℃馏分高,原因是。(5)、若反应中缺少二甲胺,相同条件下几乎没有产品得到,说明二甲胺在反应中起到的作用。反应温度控制在90±5℃的原因可能是。(6)、本实验所得到的苯乙腈产率是(保留三位有效数字)。20. 有机物M是一种合成镇痛药的主要成分,原料A是4-甲基苯酚。某小组设计如图的合成路线:
已知:①
 +
+ 
 +HX(X为卤素原子,R为H或烃基,下同)
+HX(X为卤素原子,R为H或烃基,下同)②
 +
+ 
 (1)、A的结构简式为 , A→B的反应类型为。(2)、D中所含官能团共种;检验H中是否含有G的试剂为;(3)、H与足量氢氧化钠反应的化学方程式为。(4)、M的分子式比B少一个 , 同时满足下列条件的M的结构有种。
(1)、A的结构简式为 , A→B的反应类型为。(2)、D中所含官能团共种;检验H中是否含有G的试剂为;(3)、H与足量氢氧化钠反应的化学方程式为。(4)、M的分子式比B少一个 , 同时满足下列条件的M的结构有种。①M属于芳香族化合物。
②M能与饱和溶液反应。
(5)、参照上述合成路线和信息,以 和有机化合物A为原料(其他无机试剂任选),设计制备
和有机化合物A为原料(其他无机试剂任选),设计制备 的合成路线。
的合成路线。