北京市西城区2021-2022学年高二下学期期末化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 下列物品中,主要成分属于有机高分子的是( )
A
B
C
D




塑料浴盆
陶瓷花瓶
不锈钢汤匙
玻璃水杯
A、A B、B C、C D、D2. 下列物质的用途中,错误的是( )A、醋酸可除水垢 B、乙烯可用于催熟果实 C、丙三醇可用于配制化妆品 D、油脂在酸性条件下水解用于制作肥皂3. 某烷烃的结构简式如图,其系统命名正确的是( )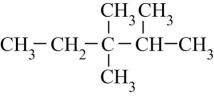 A、2,3,3-三甲基戊烷 B、3,3,4-三甲基戊烷 C、2,3-二甲基-2-乙基丁烷 D、2,3-二甲基-3-乙基丁烷4. 下列有机化合物分子中,所有原子不可能位于同一平面的是( )A、乙烯 B、乙炔 C、苯 D、甲苯5. 下列化学用语或模型错误的是( )A、苯的实验式:CH B、乙烯的结构简式:CH2CH2 C、乙炔的球棍模型:
A、2,3,3-三甲基戊烷 B、3,3,4-三甲基戊烷 C、2,3-二甲基-2-乙基丁烷 D、2,3-二甲基-3-乙基丁烷4. 下列有机化合物分子中,所有原子不可能位于同一平面的是( )A、乙烯 B、乙炔 C、苯 D、甲苯5. 下列化学用语或模型错误的是( )A、苯的实验式:CH B、乙烯的结构简式:CH2CH2 C、乙炔的球棍模型: D、甲基的电子式:
D、甲基的电子式: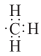 6. 某烃与氢气发生反应后能生成
6. 某烃与氢气发生反应后能生成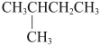 , 则该烃不可能是( ) A、
, 则该烃不可能是( ) A、 B、
B、 C、
C、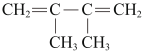 D、
D、 7. 下列事实不能说明基团间存在影响的是( )A、氯乙酸的酸性强于乙酸 B、苯酚能和溴水反应而苯不能 C、甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 D、乙烯能使酸性高锰酸钾溶液褪色而乙烷不能8. 维生素C的结构如图所示。下列说法错误的是( )
7. 下列事实不能说明基团间存在影响的是( )A、氯乙酸的酸性强于乙酸 B、苯酚能和溴水反应而苯不能 C、甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 D、乙烯能使酸性高锰酸钾溶液褪色而乙烷不能8. 维生素C的结构如图所示。下列说法错误的是( )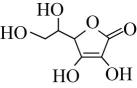 A、分子式是C6H8O6 B、分子中含有多个羟基,其水溶性较好 C、分子中含有碳碳双键、羟基、醚键3种官能团 D、能使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色9. 下列实验方案不能达到实验目的的是( )
A、分子式是C6H8O6 B、分子中含有多个羟基,其水溶性较好 C、分子中含有碳碳双键、羟基、醚键3种官能团 D、能使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色9. 下列实验方案不能达到实验目的的是( )A.检验乙醇与浓硫酸共热生成乙烯
B.检验1-溴丁烷发生消去反应生成丁烯


C.验证乙酸、碳酸、苯酚的酸性强弱
D.检验电石与水反应生成乙炔

 A、A B、B C、C D、D10. 常温下,乙酰苯胺是一种具有解热镇痛作用的白色晶体,20℃时在乙醇中的溶解度为36.9g,在水中的溶解度如下表(注:氯化钠可分散在醇中形成胶体)
A、A B、B C、C D、D10. 常温下,乙酰苯胺是一种具有解热镇痛作用的白色晶体,20℃时在乙醇中的溶解度为36.9g,在水中的溶解度如下表(注:氯化钠可分散在醇中形成胶体)温度/℃
25
50
80
100
溶解度/g
0.56
0.84
3.5
5.5
某种乙酰苯胺样品中混入了少量氯化钠杂质,下列提纯乙酰苯胺的方法正确的是( )
A、用水溶解后分液 B、用乙醇溶解后过滤 C、用水作溶剂进行重结晶 D、用乙醇作溶剂进行重结晶11. 某网状吸水性高分子树脂的部分结构如图所示,其制备方法是:将有机化合物A用NaOH部分中和,加入交联剂乙二醇,再引发聚合。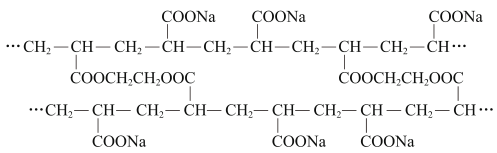
下列说法错误的是( )
A、有机化合物A是CH2=CH-COOH B、制备过程中主要发生了中和反应、酯化反应和缩聚反应 C、该高分子树脂的吸水性与-COONa有关 D、网状结构有利于提高材料的保水能力12. 已知H2O2分子的空间结构可在二面角中表示(如图所示),则有关H2O2结构的说法错误的是( ) A、分子中含有极性键和非极性键 B、H2O2是非极性分子,难溶于水 C、O采用sp3杂化 D、H-O与O-O形成的键角小于109°28′13. 碱金属氯化物是典型的离子化合物,NaCl和CsCl的晶胞结构如图所示。其中的碱金属离子能够与冠醚形成超分子。
A、分子中含有极性键和非极性键 B、H2O2是非极性分子,难溶于水 C、O采用sp3杂化 D、H-O与O-O形成的键角小于109°28′13. 碱金属氯化物是典型的离子化合物,NaCl和CsCl的晶胞结构如图所示。其中的碱金属离子能够与冠醚形成超分子。
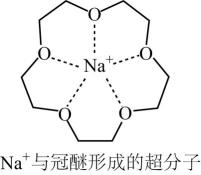
下列说法错误的是( )
A、NaCl晶胞中a为Na+ B、CsCl晶体中Cs+周围紧邻8个Cl- C、碱金属离子与冠醚通过离子键形成超分子 D、不同空穴尺寸的冠醚可以对不同碱金属离子进行识别14. 将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O△H。用该溶液做实验,溶液的颜色变化如图: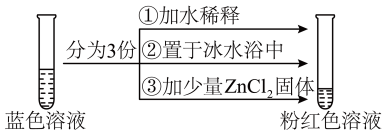
已知:[Co(H2O)6]2+粉红色、[CoCl4]2—蓝色、[ZnCl4]2-无色,下列结论和解释正确的是( )
A、[Co(H2O)6]2+和[CoCl4]2—的Co2+配位数之比为2︰3 B、由实验①可知平衡逆向移动 C、由实验②可推知△H<0 D、由实验③可知配离子的稳定性:[ZnCl4]2-<[CoCl4]2-二、综合题
-
15. CO2的资源化利用是解决温室效应的重要途径。科学家致力于CO2与H2反应制CH3OH的研究。(1)、CO2分子中碳原子的杂化轨道类型为;干冰是很好的致冷剂,干冰升华时,CO2需要克服的作用力是。(2)、CH3OH所含有的三种元素电负性从大到小的顺序为(用元素符号表示)。(3)、CH3OH的沸点比CO2高,主要原因是。(4)、CH3OH被氧化为HCHO,HCHO继续被氧化可生成HCOOH。HCHO分子的空间结构为 , HCOOH分子内σ键与π键个数之比为。16. 砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。(1)、基态In的价层电子排布式为5s25p1 , In在周期表中的位置是。(2)、在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。
已知:AsCl3和InCl3均为分子晶体,AsCl3气化室的温度为130℃,InCl3气化室的温度为500℃。
①AsCl3分子的空间结构为 , 中心原子As的杂化轨道类型为。
②AsCl3气化室温度低于InCl3气化室温度的原因是。
③InCl3晶体中分子间存在配位键,配位原子是。
(3)、InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如图所示。
①一个晶胞中所含As的个数为。
②已知该晶胞棱长为apm(1pm=1×10-10cm),阿伏加德罗常数为NA , InAs的摩尔质量为Mg•mol-1 , 则该晶体的密度ρ=g•cm-3。
17. 有机化合物A可由葡萄糖发酵得到,在医药和食品领域中有广泛应用,研究有机化合物A的分子结构、性质如下:(1)、确定A的分子式经元素分析得到化合物A的实验式为CH2O,通过法(填仪器分析方法)可以测得A的相对分子质量为90,则A的分子式为。
(2)、确定A的分子结构使用现代分析仪器对A的分子结构进行测定,结果如图:
谱图
数据分析结果
红外光谱

含有-COOH、-OH
核磁共振氢谱

峰面积比为1︰1︰1︰3
A的结构简式为。
(3)、研究A的结构和性质的关系①A的分子存在两种空间结构,它们具有完全相同的组成和原子排列,却互为镜像,具有不同的光学性质,两种分子的关系为(填字母,下同)。
a.碳架异构 b.位置异构 c.官能团异构 d.手性异构
②根据A的结构推测,有机化合物A不能发生的反应有。
a.取代反应 b.加聚反应 c.消去反应 d.酯化反应
③已知:电离常数Ka(A)=1.38×10-4 , Ka(丙酸)=1.38×10-5 , 分析数据可知A的酸性强于丙酸,请从共价键极性的角度解释原因。
(4)、A通过缩聚反应得到的产物可用作手术缝合线,能直接在人体内降解吸收。A发生缩聚反应的化学方程式是。18. 聚乙烯醇滴眼液可治疗眼部干涩等,主要成分是 , 某同学设计其合成路线如图:
, 某同学设计其合成路线如图:
已知:R1COOR2+R3OHR1COOR3+R2OH
(1)、①的化学方程式是。(2)、试剂a是。(3)、②的反应类型是。(4)、乙酸乙烯酯有多种同分异构体,其中能与NaHCO3溶液反应放出气体的有(不考虑立体异构):CH2=CH-CH2-COOH、、(填结构简式)。(5)、③的化学方程式是。(6)、设计由乙烯制备B(C2H4O2)的合成路线(参照下述示例,注明物质与条件)。甲乙……目标产物
(7)、工业上利用反应:CH≡CH+CH3COOH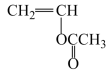 制备中间产物乙酸乙烯酯,其优点是(答一条即可)。 19. 布洛芬具有良好的解热镇痛功效,一种缓释布洛芬M的合成路线如图:
制备中间产物乙酸乙烯酯,其优点是(答一条即可)。 19. 布洛芬具有良好的解热镇痛功效,一种缓释布洛芬M的合成路线如图:
已知:
 (1)、A能够发生银镜反应,A含有的官能团为。(2)、下列有关B的说法正确的有(填字母)。
(1)、A能够发生银镜反应,A含有的官能团为。(2)、下列有关B的说法正确的有(填字母)。a.存在顺反异构
b.与A互为同系物
c.1molB最多可以和2molH2发生加成反应
(3)、C→D的化学方程式是。(4)、F是制备布洛芬的重要中间体。①F的结构简式为。
②获得F的操作如下:异丁基苯与乙酸酐反应完全后,将混合物倾入适量冰水中静置,通过(填操作名称,下同)分出油层,油层经水洗干燥后,再经可得到无色液体F。
(5)、布洛芬的结构简式为。(6)、将布洛芬嫁接到高分子基体E上,可制得缓释药物M。M在人体中可以水解缓慢释放出布洛芬;若1molM完全水解,消耗水的物质的量为mol。20. 喹啉( )及其衍生物是合成药物的重要原料。化合物G是一种取代喹啉醇,合成路线如图:
)及其衍生物是合成药物的重要原料。化合物G是一种取代喹啉醇,合成路线如图:
已知:
i.

ii.
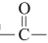 +
+

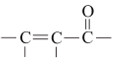 +H2O
+H2Oiii.

 (1)、试剂a是。(2)、A→B的反应类型是。(3)、物质X可以是。(4)、C+Y→D的化学方程式是。(5)、由D合成G的三步反应如图:
(1)、试剂a是。(2)、A→B的反应类型是。(3)、物质X可以是。(4)、C+Y→D的化学方程式是。(5)、由D合成G的三步反应如图:D→中间产物1→中间产物2

①中间产物1、中间产物2的结构简式分别是、。
②该过程中还会生成副产物H,H也是一种取代喹啉醇且与G互为同分异构体。H的结构简式是。