安徽省宣城市2020-2021学年高二下学期期末调研化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 下列有关化学用语表示正确的是( )A、乙烯的结构简式: B、次氯酸的结构式:H—O—Cl C、碳酸氢钠在水溶液中的电离方程式: D、氯化铵的电子式:
 2. 2020年12月17日,嫦娥五号返回着陆成功,标志着我国探月计划取得突破进展。下列有关嫦娥五号的说法正确的是( )A、使用的钛铝合金材料外壳,其硬度高于各成分金属 B、采用的锂离子电池和光电池均能将化学能转化为电能 C、取回的月壤中含有的玻璃质,是一种新的化合物 D、展示的国旗材料为聚酰胺,是一种无机非金属材料3. 设代表阿伏加德罗常数的值。下列说法错误的是( )A、8g中含有共价键个数为2 B、10g中含有电子数为5 C、通常状况下,气体所含的分子数小于0.5 D、和组成的混合气体中含有分子总数为4. 下列有关水处理过程中涉及的离子方程式书写正确的是( )
2. 2020年12月17日,嫦娥五号返回着陆成功,标志着我国探月计划取得突破进展。下列有关嫦娥五号的说法正确的是( )A、使用的钛铝合金材料外壳,其硬度高于各成分金属 B、采用的锂离子电池和光电池均能将化学能转化为电能 C、取回的月壤中含有的玻璃质,是一种新的化合物 D、展示的国旗材料为聚酰胺,是一种无机非金属材料3. 设代表阿伏加德罗常数的值。下列说法错误的是( )A、8g中含有共价键个数为2 B、10g中含有电子数为5 C、通常状况下,气体所含的分子数小于0.5 D、和组成的混合气体中含有分子总数为4. 下列有关水处理过程中涉及的离子方程式书写正确的是( )选项
水处理方法
离子方程式
A
沉淀法:用处理含废水
B
中和法:用生石灰中和酸性废水
C
氧化法:用HClO处理氨氮废水
D
絮凝法:用明矾作净水剂
A、A B、B C、C D、D5. 下列既属于吸热反应,又属于氧化还原反应的是( )A、过氧化钠与水反应 B、煅烧石灰石 C、铝和稀盐酸反应 D、碳和水蒸气的反应6. 下列实验操作规范且能达到目的的是( )



A.除去氯气中的HCl
B.熔融NaOH固体
C.验证还原性
D.验证C、Si的非金属性
A、A B、B C、C D、D7. 由制铝工业废渣(主要含Fe、Ca、Si、Al等的氧化物)制聚合硫酸铁铝净水剂的流程如下。
下列有关说法正确的是( )
A、浸取过程中的H2O2可用KMnO4溶液代替 B、废渣中四种元素的氧化物均能被稀硫酸溶解 C、聚合硫酸铁铝具有杀菌消毒的作用 D、滤液中存在的阳离子有:H+、Fe3+、Ca2+、Al3+8. 已知W、X、Y、Z、M是原子序数依次增大的五种短周期主族元素,其中W的某种原子无中子,X的原子最外层电子数是其电子层数的3倍,Y的原子半径在短周期中最大,Z单质为淡黄色粉末。下列说法正确的是( )A、离子半径:Y>Z>M B、X、Z、M均可以和W构成18电子分子 C、最高价氧化物对应水化物的酸性:Z>M D、X与Y形成的化合物中只含离子键9. 化学创造美好生活。下列生产活动中涉及到的化学原理,错误的是( )选项
生产活动
化学原理
A
低温条件下进行新冠疫苗的生产与储运
避免温度过高使疫苗中蛋白质变性
B
以海水为原料制取溴和镁单质
可被还原、可被氧化
C
用丙烯合成聚丙烯(口罩熔喷布主要成分)
烯烃可发生加聚
D
用次氯酸钠溶液杀灭新冠病毒
次氯酸钠具有强氧化性
A、A B、B C、C D、D10. 下列有关实验基本操作的叙述中,正确的是( )A、定容时俯视会使所配溶液的物质的量浓度偏高 B、用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 C、用玻璃棒蘸取待测溶液点在湿润的pH试纸上测定溶液的pH D、酸碱中和滴定操作过程中眼睛始终注视滴定管液面变化11. 有机物M是合成青蒿素的原料之一,M的结构简式如图所示。下列有关M的说法正确的是( ) A、分子式为 B、能发生氧化反应 C、1molM能与4molNaOH反应 D、烃基上的一氯代物只有一种12. 图a~c分别为NaCl在不同状态下的导电实验(X、Y均为石墨电极微观示意图。下列分析正确的是( )
A、分子式为 B、能发生氧化反应 C、1molM能与4molNaOH反应 D、烃基上的一氯代物只有一种12. 图a~c分别为NaCl在不同状态下的导电实验(X、Y均为石墨电极微观示意图。下列分析正确的是( ) A、图中白球代表 B、图a可表示熔融的NaCl,不导电 C、图b中X作阳极,发生氧化反应 D、图c中电解时X、Y上产生物质的物质的量之比为1∶213. 室温下,关于氨水的下列说法正确的是( )A、该氨水的pH=13 B、加入少量水后,溶液中所有离子浓度均减小 C、加少量固体恢复到室温,不变 D、与盐酸混合后,溶液呈中性14. 一定温度下,在一容积为2L的密闭容器内发生反应:。已知起始投入2molA(g)和1molB(s),经2min后达到平衡,测得C的浓度为。下列说法正确的是( )A、0~2min内,用物质B表示的平均反应速率为 B、达平衡时,A的转化率为20% C、向平衡体系中再充入1molA(g),平衡正向移动,A的转化率增大 D、反应开始与达平衡时容器的压强之比为1∶115. 我国计划在2060年实现“碳中和”的目标。为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳。工作原理如图所示,下列说法错误的是( )
A、图中白球代表 B、图a可表示熔融的NaCl,不导电 C、图b中X作阳极,发生氧化反应 D、图c中电解时X、Y上产生物质的物质的量之比为1∶213. 室温下,关于氨水的下列说法正确的是( )A、该氨水的pH=13 B、加入少量水后,溶液中所有离子浓度均减小 C、加少量固体恢复到室温,不变 D、与盐酸混合后,溶液呈中性14. 一定温度下,在一容积为2L的密闭容器内发生反应:。已知起始投入2molA(g)和1molB(s),经2min后达到平衡,测得C的浓度为。下列说法正确的是( )A、0~2min内,用物质B表示的平均反应速率为 B、达平衡时,A的转化率为20% C、向平衡体系中再充入1molA(g),平衡正向移动,A的转化率增大 D、反应开始与达平衡时容器的压强之比为1∶115. 我国计划在2060年实现“碳中和”的目标。为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳。工作原理如图所示,下列说法错误的是( ) A、熔盐中的用于捕获而消耗 B、过程②中在a极上发生了氧化反应 C、电极b连接电源的负极 D、电解总反应为16. 在常温下,向20.00mL溶液中滴加溶液,溶液中随pH的变化关系如图所示。下列说法正确的是( )
A、熔盐中的用于捕获而消耗 B、过程②中在a极上发生了氧化反应 C、电极b连接电源的负极 D、电解总反应为16. 在常温下,向20.00mL溶液中滴加溶液,溶液中随pH的变化关系如图所示。下列说法正确的是( ) A、当溶液的pH=7时, B、当溶液的pH=4.76时,消耗NaOH溶液10.00mL C、随着NaOH溶液的滴加,溶液pH增大,水的电离程度减小 D、b点溶液中:
A、当溶液的pH=7时, B、当溶液的pH=4.76时,消耗NaOH溶液10.00mL C、随着NaOH溶液的滴加,溶液pH增大,水的电离程度减小 D、b点溶液中:二、填空题
-
17. 回答下列问题:(1)、用离子方程式表示碳酸钠溶液显碱性的主要原因:。(2)、亚磷酸()与足量NaOH溶液反应生成 , 从分类角度来看,属于(选填“酸式盐”、“正盐”或“碱式盐”)。(3)、等体积、等物质的量浓度的三种溶液:①盐酸②醋酸③硫酸,用某浓度NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小顺序为(用序号表示)。(4)、常温下,等体积、等物质的量浓度的盐酸与氨水混合后,溶液中水电离出的(填“>”、“=”或“<”)。(5)、25℃,向物质的量浓度均为的和混合溶液中,滴加溶液,首先沉淀的离子是 , 当两种难溶电解质均沉淀时,溶液中。[25℃, , ]18. 乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以TB表示)催化合成ETBE.反应为。向刚性恒容容器中按物质的量之比1∶1充入乙醇和异丁烯,在温度为与时异丁烯的转化率随时间变化如图所示。

回答下列问题:
(1)、与乙醇互为同分异构体的某有机物的结构简式为 , 异丁烯的官能团名称为。(2)、(选填“>”、“=”或“<”),该反应的正反应为(选填“吸热”或“放热”)反应。(3)、a、b、c三点,逆反应速率最大的点是。(4)、时,容器内起始总压为 , 则平衡常数(为压强平衡常数,用平衡分压代替平衡浓度计算)。三、综合题
-
19. 实验室用图示装置制备KClO溶液,再与KOH、溶液反应制备高效净水剂高铁酸钾()。

【查阅资料】
①与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成。
②为紫黑色晶体,易溶于水、微溶于浓KOH溶液,在0~5℃的强碱性溶液中较稳定。
【制备KClO及】
(1)、装置C中盛放KOH溶液的仪器名称为 , 该仪器置于冰水浴中的目的是。开始实验时,打开分液漏斗下端活塞,发现浓盐酸不能顺利滴下,其原因可能是。(2)、装置B中盛装的是 , 装置D的作用是。(3)、C中得到足量KClO后,将其导管取下,依次加入KOH溶液、溶液,水浴控制反应温度为25℃,搅拌1.5h,溶液变为紫红色,该反应的离子方程式为。反应结束后再加入饱和KOH溶液,析出紫黑色晶体,过滤得到粗产品。(4)、称取提纯后的样品0.2100g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250mL溶液,取出25.00mL放入锥形瓶,用的溶液滴定至终点,重复操作2次,平均消耗溶液30.00mL。上述过程涉及的主要反应为:,
,
则该样品的纯度为%(保留两位小数)。
20. 以黄铁矿为原料制硫酸产生的硫酸渣中含、、、等杂质。现以硫酸渣制备铁红()的过程如下: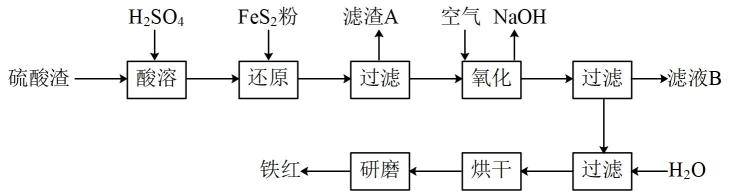
请回答下列问题:
(1)、中硫元素化合价为 , 滤渣A的名称为。(2)、酸溶时,粉碎硫酸渣的目的是 , 酸溶过程中,溶解的离子方程式是。(3)、配平下列离子方程式:。______
(4)、检验铁红中铁元素的实验方法是。(5)、现有黄铁矿烧渣500t,其中铁元素的质量分数为16.8%,经过一系列转化后,得到72t铁红,该产品的产率为%。21. CO、CH4都是重要的化工原料。回答下列问题。(1)、利用CO和H2合成的甲醇是一种清洁能源,也是一种基础化工原料。已知:化学键
C-H
C-O
C≡O
H-H
O-H
键能/
413
351
1076
436
462
则CO和H2合成CH3OH (g)的热化学方程式为。
(2)、用催化还原可以消除氮氧化物的污染。例如:若用标准状况下1.12L还原至 , 整个过程中转移电子总数为(阿伏加德罗常数的值用表示),放出的热量为kJ。
(3)、下图是甲烷碱性燃料电池工作原理示意图:
①b电极为极,a极电极反应式为。
②若用该燃料电池电解溶液(惰性电极),当消耗标准状况下时,溶液pH=。