安徽省阜阳市2021-2022学年高二下学期期末统测化学试题
试卷更新日期:2022-08-08 类型:期末考试
一、单选题
-
1. 新型冠状病毒属于核糖核酸(RNA)病毒。下列物质不属于核糖核酸水解产物的是( )A、碱基 B、核糖 C、脱氧核糖 D、磷酸2. 下列几种装置中,能用于制取氨气的是( )A、
 B、
B、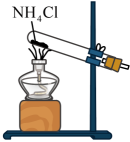 C、
C、 D、
D、 3. 下列指定反应的离子方程式正确的是( )A、溶液中加入过量澄清石灰水: B、用铝粉和NaOH溶液反应制取少量: C、溶于过量的氢碘酸溶液中: D、溶液中滴加稀盐酸:4. 短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的2倍,Y与W属于同一主族且W原子的核外电子数是Y原子的2倍,Z是短周期原子半径最大的元素。下列说法正确的是( )A、原子半径:r(W)>r(Y)>r(X) B、Z与Y形成的化合物是离子化合物 C、X的最高氧化物对应水化物的酸性比W的强 D、Y的简单气态氢化物的热稳定性比W的弱5. 下列有机物中一氯取代物有3种的是( )A、
3. 下列指定反应的离子方程式正确的是( )A、溶液中加入过量澄清石灰水: B、用铝粉和NaOH溶液反应制取少量: C、溶于过量的氢碘酸溶液中: D、溶液中滴加稀盐酸:4. 短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的2倍,Y与W属于同一主族且W原子的核外电子数是Y原子的2倍,Z是短周期原子半径最大的元素。下列说法正确的是( )A、原子半径:r(W)>r(Y)>r(X) B、Z与Y形成的化合物是离子化合物 C、X的最高氧化物对应水化物的酸性比W的强 D、Y的简单气态氢化物的热稳定性比W的弱5. 下列有机物中一氯取代物有3种的是( )A、 B、
B、 C、
C、 D、
D、 6. 合成橡胶
6. 合成橡胶 的单体是( ) A、CH2=CHCH=CH2和CH2=CHCN B、CH2=CH2和CH2=CHCN C、CH2=CHCH=CHCH=CHCN D、CH2=CH2和CH2=CHCH=CHCN7. 合成氨反应中物质的能量与反应过程的关系如图所示。已知键能、。下列说法正确的是( )
的单体是( ) A、CH2=CHCH=CH2和CH2=CHCN B、CH2=CH2和CH2=CHCN C、CH2=CHCH=CHCH=CHCN D、CH2=CH2和CH2=CHCH=CHCN7. 合成氨反应中物质的能量与反应过程的关系如图所示。已知键能、。下列说法正确的是( ) A、一定条件下,反应能自发进行的原因是 B、 C、合成氨使用催化剂是为了提高反应物的平衡转化率 D、合成氨使用高温的目的是提高反应物的平衡转化率,使用高压的目的是增大反应速率8. 下列有关电化学原理及应用的说法正确的是( )
A、一定条件下,反应能自发进行的原因是 B、 C、合成氨使用催化剂是为了提高反应物的平衡转化率 D、合成氨使用高温的目的是提高反应物的平衡转化率,使用高压的目的是增大反应速率8. 下列有关电化学原理及应用的说法正确的是( ) A、纯铁比钢铁更容易发生电化学腐蚀 B、铁制品表面镀锌时,铁制品应与电源正极相连 C、电解精炼铜时,电路中每转移2mol电子,阴极质量增加64g D、如图装置中正极反应式为9. 实验室回收废水中苯酚的过程如图所示。下列说法正确的是( )
A、纯铁比钢铁更容易发生电化学腐蚀 B、铁制品表面镀锌时,铁制品应与电源正极相连 C、电解精炼铜时,电路中每转移2mol电子,阴极质量增加64g D、如图装置中正极反应式为9. 实验室回收废水中苯酚的过程如图所示。下列说法正确的是( ) A、操作I为蒸馏 B、反应Ⅰ也可加入NaHCO3 C、操作Ⅱ所得有机层可循环利用 D、操作Ⅲ所得水层为Na2CO3溶液10. 下列根据实验事实所得推论正确的是( )A、苯和溴水不反应,苯酚和溴水反应生成三溴苯酚,说明羟基对苯环有影响 B、甲烷、苯均不能使酸性溶液褪色,而甲苯能被酸性溶液氧化成苯甲酸,说明甲基对苯环的性质有影响 C、乙醇不能与氢氧化钠溶液反应生成乙醇钠,苯酚与氢氧化钠溶液反应生成苯酚钠,说明羟基影响了苯环 D、苯不能与溴水反应,环己烯能与溴水反应,说明环状结构对碳碳双键的性质有影响11. 有机物Z可通过如下反应得到。下列说法正确的是( )
A、操作I为蒸馏 B、反应Ⅰ也可加入NaHCO3 C、操作Ⅱ所得有机层可循环利用 D、操作Ⅲ所得水层为Na2CO3溶液10. 下列根据实验事实所得推论正确的是( )A、苯和溴水不反应,苯酚和溴水反应生成三溴苯酚,说明羟基对苯环有影响 B、甲烷、苯均不能使酸性溶液褪色,而甲苯能被酸性溶液氧化成苯甲酸,说明甲基对苯环的性质有影响 C、乙醇不能与氢氧化钠溶液反应生成乙醇钠,苯酚与氢氧化钠溶液反应生成苯酚钠,说明羟基影响了苯环 D、苯不能与溴水反应,环己烯能与溴水反应,说明环状结构对碳碳双键的性质有影响11. 有机物Z可通过如下反应得到。下列说法正确的是( ) A、1molX与足量NaOH反应,最多可以消耗2molNaOH B、Y分子存在顺反异构现象 C、Z中所有碳原子一定位于同一平面 D、可用溶液检验Z中是否存在X12. 实验室通过如图所示装置制取乙烯并验证其性质。下列说法正确的是( )
A、1molX与足量NaOH反应,最多可以消耗2molNaOH B、Y分子存在顺反异构现象 C、Z中所有碳原子一定位于同一平面 D、可用溶液检验Z中是否存在X12. 实验室通过如图所示装置制取乙烯并验证其性质。下列说法正确的是( ) A、装置甲反应时应控制温度为140℃ B、装置甲中碎瓷片的作用是作催化剂 C、为除去乙烯中混有的少量 , 装置乙中可加入NaOH溶液 D、装置丙中溶液褪色时有生成13. 某锂碘电池以固体为电解质传递离子,其基本结构示意图如图,电池总反应可表示为。下列说法正确的是( )
A、装置甲反应时应控制温度为140℃ B、装置甲中碎瓷片的作用是作催化剂 C、为除去乙烯中混有的少量 , 装置乙中可加入NaOH溶液 D、装置丙中溶液褪色时有生成13. 某锂碘电池以固体为电解质传递离子,其基本结构示意图如图,电池总反应可表示为。下列说法正确的是( ) A、放电时a极上发生还原反应 B、放电时由a极通过固体电解质传递到b极 C、b极上的电极反应式为 D、放电时电池将电能转化为化学能14. 已知常温下、HCN的电离平衡常数如下表所示。
A、放电时a极上发生还原反应 B、放电时由a极通过固体电解质传递到b极 C、b极上的电极反应式为 D、放电时电池将电能转化为化学能14. 已知常温下、HCN的电离平衡常数如下表所示。HCN
下列说法正确的是( )
A、溶液中存在: B、25℃,将HCN溶液加水稀释,溶液中变小 C、25℃,浓度均为的和NaCN溶液,pH大的是 D、向溶液中滴加0.10mol/LHCN溶液,发生反应:15. 25℃时,和的沉淀溶解平衡曲线如图(代表或)所示。下列说法错误的是( ) A、a点可表示的饱和溶液 B、c点可表示的过饱和溶液,达新平衡时可到达b点 C、d点时溶液中存在(忽略单位) D、用溶液浸泡足量 , 会有部分转化为16. 向体积均为2L的两个恒容密闭容器中分别充入 , 维持容器的温度分别为T1℃和T2℃不变,发生反应: 。反应过程中的转化率随时间的变化如图所示。下列说法正确的是( )
A、a点可表示的饱和溶液 B、c点可表示的过饱和溶液,达新平衡时可到达b点 C、d点时溶液中存在(忽略单位) D、用溶液浸泡足量 , 会有部分转化为16. 向体积均为2L的两个恒容密闭容器中分别充入 , 维持容器的温度分别为T1℃和T2℃不变,发生反应: 。反应过程中的转化率随时间的变化如图所示。下列说法正确的是( ) A、a<0 B、T1℃时,0~100min内,反应的平均速率 C、T2℃时,使用合适的催化剂,可使的平衡转化率与T1℃时相同 D、T2℃时,向平衡后的容器中充入少量 , 此时反应向正反应方向进行
A、a<0 B、T1℃时,0~100min内,反应的平均速率 C、T2℃时,使用合适的催化剂,可使的平衡转化率与T1℃时相同 D、T2℃时,向平衡后的容器中充入少量 , 此时反应向正反应方向进行二、综合题
-
17. 工业上以碳酸锰矿为主要原料先制取 , 再以为原料生产的工艺流程如下:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
开始沉淀的pH
1.5
3.3
6.2
6.5
8.0
8.3
沉淀完全的pH
3.2
5.2
8.2
9.7
8.8
9.8
(1)、酸浸时为加快浸取时的速率,采取的措施除将碳酸锰矿粉碎、适当增加硫酸的浓度、充分搅拌外,还可以采取的措施是。(任写一种)(2)、酸浸后的溶液中含有、 , 另含有少量、、、、等。写出氧化时所发生反应的离子方程式:。(3)、除杂时可依次加入和。①为除去溶液中的铁元素和铝元素,可加入调节溶液的pH。调节pH时需控制pH的范围是。
②加入除去溶液中铝元素时所发生反应的离子方程式为。
③加入 , 可除去、。当ZnS、PbS沉淀共存时,溶液中。[已知 , ]
(4)、沉锰后所得的需进行洗涤,检验沉淀是否洗净的方法是。(5)、写出灼烧时反应的化学方程式:。18. 水合肼()是一种易挥发的无色液体,具有强还原性。实验室可通过如图所示流程制取水合肼液体。 (1)、已知反应1为放热反应,反应的目的是制取NaClO,NaClO受热不稳定,受热分解为NaCl和。
(1)、已知反应1为放热反应,反应的目的是制取NaClO,NaClO受热不稳定,受热分解为NaCl和。①写出反应1的离子方程式:。
②为防止生成的NaClO分解,可采取的方法是。
(2)、由反应1所得溶液与溶液混合可以制取水合肼,装置如图所示。混合时应将一种溶液缓慢滴加到另一溶液中并不断搅拌。烧瓶中的溶液是 , 理由是。 (3)、写出反应2的化学方程式:(4)、分离出水合肼液体的操作方法是19. 乙烯是有机合成工业重要的原料,由乙烷制取乙烯是常见的方法。已知乙烷热裂解法制取乙烯的反应为 。(1)、一定温度下,在乙烷热裂解制取乙烯时,向体系中充入一定量惰性气体,保持体系的总压强为100kPa,测得平衡时各组分的体积分数如下表所示:
(3)、写出反应2的化学方程式:(4)、分离出水合肼液体的操作方法是19. 乙烯是有机合成工业重要的原料,由乙烷制取乙烯是常见的方法。已知乙烷热裂解法制取乙烯的反应为 。(1)、一定温度下,在乙烷热裂解制取乙烯时,向体系中充入一定量惰性气体,保持体系的总压强为100kPa,测得平衡时各组分的体积分数如下表所示:物质
体积分数
5%
20%
20%
该温度下反应的平衡常数kPa,(用物质的平衡分压代替平衡浓度,平衡分压=总压强X体积分数)
(2)、利用膜分离技术可以实现边反应边分离出生成的。在容积为1L的恒容密闭容器中充入1mol乙烷,测得不同氢气移出率α[]条件下,乙烷的平衡转化率与和温度的关系如图-1所示。
①α1(填“>”、“<”或“=”) α2。
②若A点时平衡常数K=0.8,则α1=。
(3)、以和为原料可以协同制取和CO,发生的反应如下:反应1:
反应2:
①已知 。
则的。
②0.1MPa时,按物质的量之比为1:1向密闭容器中充入和的混合气体,反应相同时间,测得和的转化率与温度的关系如图-2所示。X代表的物质是。750~820℃时,随着温度的升高,容器中的值的变化情况是。

③乙烷热裂解时,会产生积碳,以和为原料协同制取和CO会减少积碳的产生,原因是。
20. H是一种治疗心血管的药物,其一种合成路线如下。
已知:R1CHO+

 (1)、A中所含的官能团除醚键外还有(填名称)。(2)、A→B的反应分为两步,第一步是加成反应,则第二步的反应类型为。(3)、C的结构简式为。(4)、试剂X的分子式为 , 写出X的结构简式:。(5)、F→G的反应类型是。(6)、Y的分子式为 , Y的名称为。(7)、A的同分异构体中,含有苯环并能发生水解反应的化合物共有种。
(1)、A中所含的官能团除醚键外还有(填名称)。(2)、A→B的反应分为两步,第一步是加成反应,则第二步的反应类型为。(3)、C的结构简式为。(4)、试剂X的分子式为 , 写出X的结构简式:。(5)、F→G的反应类型是。(6)、Y的分子式为 , Y的名称为。(7)、A的同分异构体中,含有苯环并能发生水解反应的化合物共有种。