浙教版科学八年级上册第一章 第6节 物质的分离 第1课时 物质的结晶
试卷更新日期:2022-08-05 类型:同步测试
一、结晶的条件
-
1. 下列说法正确的是( )A、饱和溶液降温时一定会析出晶体 B、没有晶体析出的溶液一定不饱和 C、加少量溶质,溶质不再溶解的溶液一定饱和 D、饱和溶液的温度升高不会析出晶体2. 将80℃时的硝酸钾饱和溶液降温至20℃,析出晶体后得到的液体( )A、是水 B、是不饱和溶液 C、仍是饱和溶液 D、可能是饱和溶液3. 下列现象中,属于结晶的是( )A、将水放入冰箱冷冻室内制冰块 B、冬天从盐湖水中捞碱 C、熔化的玻璃冷却 D、碘蒸气凝华为固态碘4. 下列关于结晶和晶体的说法错误的是( )A、饱和溶液降温析出晶体后的溶液还是饱和溶液 B、降低饱和溶液的温度不一定有晶体析出 C、从溶液中析出的晶体中不一定含有结晶水 D、将溶液的溶剂蒸发掉一些一定会析出晶体
二、结晶的方法
-
5. 我国是世界上产盐最早的国家,有着悠久的制盐历史,用现在的观点来看,他们采用的结晶方法是( )A、蒸发溶剂 B、同时采用冷却热饱和溶液和蒸发溶剂的方法 C、冷却热饱和溶液 D、加热饱和溶液的方法6. 从溶液中获得固体一般有两种方法。从海水中获得食盐可用的方法,因为食盐的溶解度受温度变化影响;从硝酸钾饱和溶液中获得硝酸钾可用的方法,因为它的溶解度受温度变化影响。7. 硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
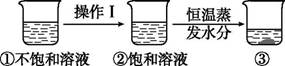 A、操作Ⅰ一定是降温,溶剂质量不变 B、②到③的操作也可以是降温 C、①与②的溶质质量分数相比,②一定比①大 D、②与③的溶质质量可能相等
A、操作Ⅰ一定是降温,溶剂质量不变 B、②到③的操作也可以是降温 C、①与②的溶质质量分数相比,②一定比①大 D、②与③的溶质质量可能相等三、晶体的制备
-
8. 在“冷却热饱和溶液来制备硫酸铜晶体”的实验中需要用到的仪器是( )A、铁架台、铁圈、烧杯、漏斗、玻璃棒、滤纸 B、烧杯、温度计、玻璃棒、酒精灯 C、铁架台、铁夹、铁圈、石棉网 D、冷凝管、酒精灯、蒸发皿、接收管9. 一定温度下,向如图所示烧杯中加入一定质量的水,仅有部分晶体溶解。所得溶液与原溶液相比,说法正确的是( )
 A、溶剂的质量增加,溶液颜色变浅 B、溶质溶解度不变,溶液颜色变深 C、溶质的质量增加,溶液颜色变深 D、溶质溶解度不变,溶液颜色不变10. 从混有少量硝酸钾的食盐晶体中提取较纯的食盐,可供选择的实验步骤有:①在较高的温度下制成该晶体的饱和溶液;②在常温下制成该晶体的饱和溶液;③升高溶液温度不断蒸发水分,直到大量固体析出;④降温至有较多量晶体析出;⑤过滤。正确的操作步骤是( )A、①④⑤ B、①④ C、②③ D、②③⑤11. 如图所示是三种物质的溶解度曲线。请回答下列问题。
A、溶剂的质量增加,溶液颜色变浅 B、溶质溶解度不变,溶液颜色变深 C、溶质的质量增加,溶液颜色变深 D、溶质溶解度不变,溶液颜色不变10. 从混有少量硝酸钾的食盐晶体中提取较纯的食盐,可供选择的实验步骤有:①在较高的温度下制成该晶体的饱和溶液;②在常温下制成该晶体的饱和溶液;③升高溶液温度不断蒸发水分,直到大量固体析出;④降温至有较多量晶体析出;⑤过滤。正确的操作步骤是( )A、①④⑤ B、①④ C、②③ D、②③⑤11. 如图所示是三种物质的溶解度曲线。请回答下列问题。 (1)、溶解度随温度升高而降低的是;30 ℃时溶解度最大的是。(2)、80 ℃时硝酸钠饱和溶液的溶质质量分数为。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有(写一种)。(3)、某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、、过滤、洗涤、干燥。(4)、30 ℃时,用等质量的硝酸钾、硝酸钠配制两种物质的饱和溶液需要水的质量:硝酸钾(填“>”“<”或“=”)硝酸钠。(5)、配制一定溶质质量分数的硝酸钾溶液,以下操作中会导致所配制溶液的溶质质量分数偏小的是 (填字母)。A、用量筒量取水时仰视读数 B、配制好的溶液向细口瓶中转移时溅出 C、硝酸钾固体中含有杂质 D、烧杯事先用水润洗过,内壁有水12. 海水是一种宝贵的资源。(1)、海水晒盐所采用的方法是 (填字母)。A、冷却结晶 B、蒸发结晶 C、过滤(2)、海上航行缺乏饮用水时可采用如图所示的装置获得淡水,用该装置将2000 g 含氯化钠3%的海水曝晒4h后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水的质量为。
(1)、溶解度随温度升高而降低的是;30 ℃时溶解度最大的是。(2)、80 ℃时硝酸钠饱和溶液的溶质质量分数为。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有(写一种)。(3)、某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、、过滤、洗涤、干燥。(4)、30 ℃时,用等质量的硝酸钾、硝酸钠配制两种物质的饱和溶液需要水的质量:硝酸钾(填“>”“<”或“=”)硝酸钠。(5)、配制一定溶质质量分数的硝酸钾溶液,以下操作中会导致所配制溶液的溶质质量分数偏小的是 (填字母)。A、用量筒量取水时仰视读数 B、配制好的溶液向细口瓶中转移时溅出 C、硝酸钾固体中含有杂质 D、烧杯事先用水润洗过,内壁有水12. 海水是一种宝贵的资源。(1)、海水晒盐所采用的方法是 (填字母)。A、冷却结晶 B、蒸发结晶 C、过滤(2)、海上航行缺乏饮用水时可采用如图所示的装置获得淡水,用该装置将2000 g 含氯化钠3%的海水曝晒4h后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水的质量为。 (3)、海水中的硼酸可用于玻璃行业,下表为硼酸的部分溶解度数据。
(3)、海水中的硼酸可用于玻璃行业,下表为硼酸的部分溶解度数据。温度/℃
0
20
40
60
80
溶解度/g
3
5
9
15
23
①60 ℃时,100 g硼酸饱和溶液中含有硼酸的质量为(结果保留整数)。
②某同学设计如下实验探究温度及固体溶质的形态对溶解速率的影响。三个烧杯中,所得溶液浓度的大小关系是。

③若要达到实验目的,需改变实验Ⅰ中的一个条件是(填字母)。
A.将20 ℃的水改为80 ℃
B.将水的体积改为50 mL
C.将粉末状固体改为块状
四、自我提升
-
13. 将20 ℃时某硝酸钾溶液均分为两份,第一份恒温蒸发掉10 g水,析出a g晶体;第二份恒温蒸发掉20 g水,析出晶体b g。则a与b的关系正确的是( )A、2a=b B、2a≤b C、2a≥b D、2a<b14. t℃时,将一定质量的某物质的不饱和溶液分成三等份,分别加热蒸发溶剂。然后把温度降至t ℃。已知从三份溶液中蒸发溶剂的质量分别为10 g、20 g、30 g,析出晶体(不含结晶水)的质量分别为a g、b g、c g,则a、b、c三者的关系是( )A、c=2b-a B、c=a+b C、c=a+2b D、c=2a+b15. 已知:氯化钠和硝酸钾在不同温度下的溶解度如下表。据表回答下列问题。
温度
10 ℃
20 ℃
30 ℃
40 ℃
50 ℃
60 ℃
70 ℃
80 ℃
氯化钠溶解度/g
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
硝酸钾溶解度/g
20.9
31.6
45.8
63.9
85.5
110
138
169
(1)、20 ℃时,将100 g氯化钠加入200 g水中,所得溶液的溶质与溶剂的质量比为(填最简整数比)。(2)、氯化钠中含有少量硝酸钾,要得到比较纯净的氯化钠,可以采用的方法是。(3)、20 ℃时将含有不溶性杂质的硝酸钾加入一定量的水中,充分搅拌后仍有100 g固体没有溶解。继续升高温度至60 ℃,充分搅拌后仍有60.8 g固体没有溶解。然后将混合物升温至80 ℃,再充分搅拌,恒温过滤,得到滤渣34.74 g则这一定量水的质量是g,原固体混合物中硝酸钾的质量分数为。