浙教版科学八上第一章 第5节 物质的溶解第4课时 溶质的质量分数
试卷更新日期:2022-08-02 类型:同步测试
一、有关溶质质量分数的计算
-
1. 下列氯化钠溶液的溶质质量分数不是15%的是( )A、100 g水中溶解15 g氯化钠 B、氯化钠与水按15∶85的质量比形成的溶液 C、100 g溶液中含15 g氯化钠 D、30 g氯化钠溶解于170 g水中所形成的溶液2. 从10 g质量分数为10%的硝酸钾溶液中取出5 g,那么剩下的5 g硝酸钾溶液的质量分数为( )A、1% B、90% C、10% D、11.1%3. 在一定的温度下,某物质的溶解度为S g,饱和溶液的溶质质量分数为A%,则S与A在数值上的关系是( )A、S=A B、S<A C、S>A D、无法确定4. 常温下将6 g氯化钠完全溶于54 g水中,将所得溶液均分成6份,请完成下列计算:(1)、第一份溶液中,溶质的质量分数为。(2)、第二份溶液中再加10 g水,溶质的质量分数为。(3)、第三份溶液中再加1 g氯化钠,若要使溶质的质量分数保持不变,则需加水g。
二、溶液的配制
-
5. 要配制100 g溶质质量分数为5%的氯化钠溶液,除了需要托盘天平和量筒外,还需要用到的一组仪器是 ( )A、烧杯、试管、玻璃棒 B、烧杯、胶头滴管、玻璃棒 C、烧杯、胶头滴管、漏斗 D、烧杯、酒精灯、玻璃棒6. 已知医用碘酒中碘的质量分数为2%,10 g碘可配制这种碘酒g,156.8 g酒精可配制这种碘酒g。7.(1)、已知:水的密度为1.0 g/mL,实验室欲配制100 g 溶质质量分数为5%的氯化钠溶液,需要称取氯化钠5 g,需要量取水。(2)、配制的操作示意图如图所示,该实验的正确操作顺序为(填字母)。
 (3)、上述操作A中玻璃棒的作用是 , 加快氯化钠的溶解。(4)、经检测,所配制溶液的溶质质量分数偏小,其原因可能是(填序号)。
(3)、上述操作A中玻璃棒的作用是 , 加快氯化钠的溶解。(4)、经检测,所配制溶液的溶质质量分数偏小,其原因可能是(填序号)。①氯化钠固体不纯
②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
8. 实验室用硝酸钾固体配制100g溶质质量分数为3%的硝酸钾溶液,下列说法正确的是( )A、用50 mL量筒量取水
B、将固体放于托盘天平的右盘称取
C、将固体直接投入量筒中溶解
D、将配制好的溶液装入贴有标签(如图)的试剂瓶中,塞好瓶塞
 9. 向200 g溶质质量分数为10%的蔗糖溶液中加入200 g水,搅拌后把所得溶液倒出一半,剩余溶液的溶质质量分数为 ( )A、10% B、5% C、2.5% D、20%10. 20 ℃时,在三个各盛有100 g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,也不与水反应)各10 g,充分溶解后,情况如下表所示,有关说法不正确的是( )
9. 向200 g溶质质量分数为10%的蔗糖溶液中加入200 g水,搅拌后把所得溶液倒出一半,剩余溶液的溶质质量分数为 ( )A、10% B、5% C、2.5% D、20%10. 20 ℃时,在三个各盛有100 g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,也不与水反应)各10 g,充分溶解后,情况如下表所示,有关说法不正确的是( )物 质
甲
乙
丙
未溶解固体的质量/g
7
0
3
A、 所得溶液可能都是饱和溶液 B、三种溶液中溶质的质量分数:乙>丙>甲 C、升高温度,三种溶液中溶质的质量分数一定都会改变 D、20 ℃时,甲的溶解度最小11. 有10%的食盐水100 g,要使其溶质质量分数变为20%,有三种方法可以达到目的,请填空。(1)、继续加入质量为g的食盐。(2)、恒温蒸发质量为g的水。(3)、与溶质质量分数大于20%的浓食盐溶液混合,若加入25%的食盐水,则混入溶液的质量为g。12. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态。分析实验过程,判断下列说法正确的是( )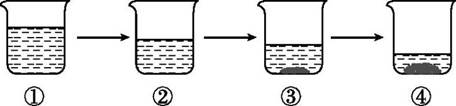 A、①→②过程中,氯化钠的质量分数保持不变 B、②→③过程中,氯化钠的溶解度不断增大 C、③→④过程中,水的质量分数不断增大 D、②→④过程中,氯化钠的质量分数先不变后增大13. 在室温条件下,对100 mL氯化钠饱和溶液进行如图所示操作。
A、①→②过程中,氯化钠的质量分数保持不变 B、②→③过程中,氯化钠的溶解度不断增大 C、③→④过程中,水的质量分数不断增大 D、②→④过程中,氯化钠的质量分数先不变后增大13. 在室温条件下,对100 mL氯化钠饱和溶液进行如图所示操作。 (1)、最终甲、乙两烧杯中的溶液一定是饱和溶液的是。(2)、向乙烧杯中加入50 mL水的过程中,下列这些量逐渐减小的是(填序号)。
(1)、最终甲、乙两烧杯中的溶液一定是饱和溶液的是。(2)、向乙烧杯中加入50 mL水的过程中,下列这些量逐渐减小的是(填序号)。①溶解度 ②溶质质量分数
③溶剂的质量 ④溶液的密度
14. A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯中分别加入25 g、10 g、5 g同种固体物质,充分溶解后,静置,现象如图所示,回答下列问题(填烧杯字母)。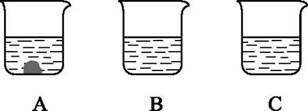 (1)、A,B,C三只烧杯中的溶液一定是不饱和溶液的是。(2)、A、B、C三只烧杯中溶液的溶质质量分数的大小关系是。15. 现有100 g溶质质量分数为15%的硝酸钾溶液,欲使其溶质质量分数增大到30%,当分别采取下列措施时,试计算:(1)、需向此溶液中加入多少克硝酸钾?(结果保留一位小数)(2)、需蒸发掉多少克水?(3)、需向此溶液中加入溶质质量分数为50%的硝酸钾溶液多少克?
(1)、A,B,C三只烧杯中的溶液一定是不饱和溶液的是。(2)、A、B、C三只烧杯中溶液的溶质质量分数的大小关系是。15. 现有100 g溶质质量分数为15%的硝酸钾溶液,欲使其溶质质量分数增大到30%,当分别采取下列措施时,试计算:(1)、需向此溶液中加入多少克硝酸钾?(结果保留一位小数)(2)、需蒸发掉多少克水?(3)、需向此溶液中加入溶质质量分数为50%的硝酸钾溶液多少克?三、自|我|提|升