浙教版科学八上第一章 第5节 物质的溶解 第3课时物质的溶解度
试卷更新日期:2022-08-02 类型:同步测试
一、溶解度的概念理解
-
1. 下列有关氯化钠(NaCl)溶解度的说法,正确的是( )A、20℃时,18.0gNaCl溶解在50g水中达到饱和状态,故20℃时,NaCl的溶解度为18.0g B、36.0g NaCl溶解在100g水中达到饱和状态,NaCl的溶解度为36.0g C、20℃时,36.0gNaCl溶解在100g水中,故20℃时,NaCl的溶解度为36.0g D、20℃时,100g水中最多能溶解36.0gNaCl,故20℃时,NaCl的溶解度为36.0g2. 某校科学探究性学习小组在测定一定温度下某物质的溶解度,则待测液必须是该温度下该物质的( )A、浓溶液 B、稀溶液 C、不饱和溶液 D、饱和溶液3. 在一个大萝卜上挖一个孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,在相同的温度下,向倒出的溶液中加入少量食盐,食盐全部溶解。此时的溶液与原饱和食盐水比较不变的是( )A、溶液质量 B、溶质质量 C、溶剂质量 D、食盐的溶解度
二、溶解度与溶解性的关系
-
4. 在20 ℃时,可根据物质在100 g水中溶解的质量,将物质分为易溶、可溶、微溶、难溶四个等级,易溶物质是指( )A、小于0.01 g B、小于1 g C、大于1 g D、大于10 g5. 20 ℃时,100 g水中最多能溶解0.165 g氢氧化钙,则氢氧化钙在水中的溶解性为( )A、 易溶 B、可溶 C、微溶 D、难溶
三、影响溶解度大小的因素
-
6. 下列因素中可以影响固体物质溶解度的有( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质 ⑤溶液是否饱和 ⑥是否搅拌 ⑦温度
A、全部 B、②④⑦ C、②④⑤⑦ D、②③④⑤⑥四、溶解度的比较与简单计算
-
7. 20℃时,取下表中的四种物质各20 g,加入100 g水中充分溶解后,有固体剩余的是( )
常见物质的溶解度(20 ℃)
物质名称
氯酸钾
硝酸钾
氯化钠
蔗糖
溶解度/g
7.4
31.6
36.0
203.9
A、 氯酸钾 B、硝酸钾 C、氯化钠 D、蔗糖8. 某温度下硝酸钾的溶解度为20 g,则此温度下硝酸钾饱和溶液中溶质质量∶溶剂质量= , 溶质质量∶溶液质量=。9. t ℃时将12 g某物质溶于30 g水中,恰好配制成该温度下的饱和溶液,则t ℃时该物质的溶解度为g;现有该温度下该物质的饱和溶液210 g,则含溶质g,溶剂g。10. 60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是( )A、 溶质质量∶溶剂质量=1∶10 B、溶剂质量∶溶液质量=20∶21 C、溶质质量∶溶剂质量=11∶10 D、溶液质量∶溶质质量=21∶1011. 硝酸钾在不同温度时的溶解度如下表所示,根据表中数据回答下列问题。t/℃
0
10
20
30
S/g
13.3
20.9
31.6
45.8
t/℃
40
50
60
70
S/g
63.9
85.5
110
138
(1)、硝酸钾的溶解性属于( )A、易溶 B、可溶 C、微溶 D、难溶(2)、与固体溶解度无关的是( )A、溶质和溶剂的质量 B、溶液的温度 C、溶质的种类 D、溶剂的种类(3)、在60 ℃时,200 g水中最多能溶解g硝酸钾。12. 硫酸镁在工农业以及医疗上有广泛应用,其溶解度如下表所示。则下列说法正确的是( )温度/℃
10
30
50
75
90
溶解度/g
27.7
39.3
49.0
54.1
51.1
A、硫酸镁的溶解度随温度升高而减小 B、10 ℃时,27.7 g硫酸镁和72.3 g水可配制成100 g硫酸镁溶液 C、50 ℃时,100 g硫酸镁不饱和溶液中溶质和溶剂的质量比为49:100 D、75 ℃时,154.1 g硫酸镁饱和溶液升温至90 ℃,溶液析出3 g溶质13. 某同学为了验证物质的溶解性与溶质、溶剂的性质有关,设计了如图B1-5-5所示的实验。分别在等质量的水和酒精中逐渐加入蔗糖和松香,直到不能继续溶解为止,比较所溶解的蔗糖和松香的多少。 (1)、同学们讨论后一致认为,上述实验方案还不能达到目的。请你将实验方案补充完整:。(2)、实验方案补充完整后,开展本实验时还应控制相同。(3)、如果观察到的现象,则验证了物质溶解性与溶剂性质有关。14. 在一定温度下,向100 g水中依次加入一定质量的氯化钾固体,充分溶解。加入氯化钾的质量与得到的相应溶液质量的关系如图B1-5-6所示。
(1)、同学们讨论后一致认为,上述实验方案还不能达到目的。请你将实验方案补充完整:。(2)、实验方案补充完整后,开展本实验时还应控制相同。(3)、如果观察到的现象,则验证了物质溶解性与溶剂性质有关。14. 在一定温度下,向100 g水中依次加入一定质量的氯化钾固体,充分溶解。加入氯化钾的质量与得到的相应溶液质量的关系如图B1-5-6所示。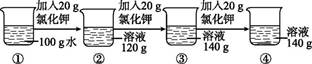 (1)、该温度下氯化钾的溶解度是g。(2)、④中的溶液是不是饱和溶液?(填“是”“不是”或“无法判断”)。15. 溶液与人们的生活息息相关。(1)、下列少量物质分别放入水中,充分搅拌,可以得到溶液的是 (填字母)。A、高锰酸钾 B、汽油 C、面粉(2)、在盛有水的烧杯中加入以下某种物质,形成溶液过程中,会使温度升高的物质是 (填字母)。A、烧碱 B、硝酸铵 C、氯化钠(3)、下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
(1)、该温度下氯化钾的溶解度是g。(2)、④中的溶液是不是饱和溶液?(填“是”“不是”或“无法判断”)。15. 溶液与人们的生活息息相关。(1)、下列少量物质分别放入水中,充分搅拌,可以得到溶液的是 (填字母)。A、高锰酸钾 B、汽油 C、面粉(2)、在盛有水的烧杯中加入以下某种物质,形成溶液过程中,会使温度升高的物质是 (填字母)。A、烧碱 B、硝酸铵 C、氯化钠(3)、下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
①60 ℃时,氯化钠的溶解度(填“>”“=”或“<”)硝酸钾的溶解度。温度/℃ 0 20 40 60 80 100 溶解度/g 氯化钠 35.7 36.0 36.6 37.3 38.4 39.8 硝酸钾 13.3 31.6 63.9 110 169 246 氢氧化钙 0.19 0.17 0.14 0.12 0.09 0.08 ②表中某物质的饱和溶液随温度升高析出固体,该物质是。
③向20 ℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20 ℃,此时溶液中溶质质量与加入生石灰前相比(填“增大”“不变”或“减小”)。
④混有少量氯化钠的硝酸钾固体,加水配成80 ℃的硝酸钾饱和溶液,再冷却至20 ℃,析出晶体并得到溶液。下列有关说法中正确的是(填字母)。
A.析出的晶体中不一定含有硝酸钾
B.所得溶液一定是硝酸钾的饱和溶液
C.上述方法可以将两种物质完全分离
五、自我提升
-