河南省洛阳市2021-2022学年高一下学期期末质量检测化学试题
试卷更新日期:2022-08-01 类型:期末考试
一、单选题
-
1. 化学与生产、生活、科技息息相关,下列叙述正确的是( )A、华为首款5G手机搭载的“麒麟980”手机芯片的主要成分是二氧化硅 B、2022年北京冬奥会吉祥物“冰墩墩”使用的聚乙烯属于高分子材料 C、“神舟十二号”宇宙飞船返回舱外表面使用的高温结构陶瓷属于有机高分子材料 D、我国科学家合成的结晶牛胰岛素属于糖类2. 下列化学用语表达正确的是( )A、HCl的电子式:
 B、乙醇的结构简式:
C、甲烷的空间填充模型:
B、乙醇的结构简式:
C、甲烷的空间填充模型: D、的结构式:
3. 下列物质的性质与用途具有对应关系的是( )A、二氧化氯具有强氧化性,可用来漂白织物 B、二氧化硫具有氧化性,可用于纸浆漂白 C、碳酸氢钠能与碱反应,可用作食品膨松剂 D、Na2O2是淡黄色固体,在呼吸面具中用作供氧剂4. 下列叙述中正确的是( )A、菠菜和黑木耳等食品中富含铁元素 B、煤的干馏和煤的液化均是物理变化 C、在一定物质的量浓度溶液配制中,定容时俯视,导致所配制溶液浓度偏小 D、油酸()和乙酸互为同系物5. 维生素C又称抗坏血酸,能够将I2转化为I- , 说明维生素C( )A、易溶于水 B、受热易分解 C、具有还原性 D、可由人体自身合成6. 某化学反应的能量变化如图所示,下列说法错误的是( )
D、的结构式:
3. 下列物质的性质与用途具有对应关系的是( )A、二氧化氯具有强氧化性,可用来漂白织物 B、二氧化硫具有氧化性,可用于纸浆漂白 C、碳酸氢钠能与碱反应,可用作食品膨松剂 D、Na2O2是淡黄色固体,在呼吸面具中用作供氧剂4. 下列叙述中正确的是( )A、菠菜和黑木耳等食品中富含铁元素 B、煤的干馏和煤的液化均是物理变化 C、在一定物质的量浓度溶液配制中,定容时俯视,导致所配制溶液浓度偏小 D、油酸()和乙酸互为同系物5. 维生素C又称抗坏血酸,能够将I2转化为I- , 说明维生素C( )A、易溶于水 B、受热易分解 C、具有还原性 D、可由人体自身合成6. 某化学反应的能量变化如图所示,下列说法错误的是( )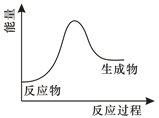 A、该反应可能不需要加热就能够发生 B、该反应断键吸收的总能量大于成键释放的总能量 C、该反应可能是化合反应,也可能是分解反应 D、该反应的化学方程式可能为 2Al+Fe2O3 Al2O3+2Fe7. 中国化学会遴选了118名青年化学家作为“元素代言人”,组成“中国青年化学家元素周期表”。第37号元素铷(Rb)由清华大学张如范代言。下列说法正确的是( )A、铷位于周期表的第四周期第IA族 B、氢氧化铷属于弱碱 C、与钠的单质相比,铷的单质熔点更低 D、硝酸铷属于共价化合物8. 下列反应中前者属于取代反应,后者属于加成反应的是( )A、光照甲烷与氯气的混合物;乙烯使酸性高锰酸钾溶液褪色 B、乙烯使溴的四氯化碳溶液褪色;乙烯与氯化氢反应生成氯乙烷 C、乙醇和乙酸反应生成乙酸乙酯;乙烯与水蒸气在一定条件下反应生成乙醇 D、乙醇使酸性高锰酸钾溶液褪色;乙烯使溴水褪色9. 如图是某食品包装袋一隅,下列说法错误的是( )
A、该反应可能不需要加热就能够发生 B、该反应断键吸收的总能量大于成键释放的总能量 C、该反应可能是化合反应,也可能是分解反应 D、该反应的化学方程式可能为 2Al+Fe2O3 Al2O3+2Fe7. 中国化学会遴选了118名青年化学家作为“元素代言人”,组成“中国青年化学家元素周期表”。第37号元素铷(Rb)由清华大学张如范代言。下列说法正确的是( )A、铷位于周期表的第四周期第IA族 B、氢氧化铷属于弱碱 C、与钠的单质相比,铷的单质熔点更低 D、硝酸铷属于共价化合物8. 下列反应中前者属于取代反应,后者属于加成反应的是( )A、光照甲烷与氯气的混合物;乙烯使酸性高锰酸钾溶液褪色 B、乙烯使溴的四氯化碳溶液褪色;乙烯与氯化氢反应生成氯乙烷 C、乙醇和乙酸反应生成乙酸乙酯;乙烯与水蒸气在一定条件下反应生成乙醇 D、乙醇使酸性高锰酸钾溶液褪色;乙烯使溴水褪色9. 如图是某食品包装袋一隅,下列说法错误的是( ) A、谷氨酸钠是增味剂的一种 B、山梨酸钾是一种营养强化剂 C、红曲红是一种着色剂 D、亚硝酸钠是一种护色剂和防腐剂10. 用下列实验装置进行相应实验,能达到实验目的的是( )
A、谷氨酸钠是增味剂的一种 B、山梨酸钾是一种营养强化剂 C、红曲红是一种着色剂 D、亚硝酸钠是一种护色剂和防腐剂10. 用下列实验装置进行相应实验,能达到实验目的的是( ) A、图1装置从KI和的固体混合物中回收 B、图2装置制备少量乙酸乙酯 C、图3装置可观察到长导管中红墨水液面上升 D、图4装置证明元素的非金属性:Cl>C>Si11. 下列溶液中的粒子一定可以大量共存的是( )A、加入Al放出的溶液:、、、 B、透明溶液:、、、 C、遇酚酞变红的溶液:、、、 D、酸性溶液:、、、12. 为阿伏加德罗常数的值。我国科学家突破人工合成淀粉技术,其主要流程如下:
A、图1装置从KI和的固体混合物中回收 B、图2装置制备少量乙酸乙酯 C、图3装置可观察到长导管中红墨水液面上升 D、图4装置证明元素的非金属性:Cl>C>Si11. 下列溶液中的粒子一定可以大量共存的是( )A、加入Al放出的溶液:、、、 B、透明溶液:、、、 C、遇酚酞变红的溶液:、、、 D、酸性溶液:、、、12. 为阿伏加德罗常数的值。我国科学家突破人工合成淀粉技术,其主要流程如下:
下列说法正确的是( )
A、与足量完全反应生成个 B、生成时,2个被还原 C、合成至少需要3个 D、1mol淀粉中,含有的分子数为513. 某温度下的恒容密闭容器中,发生反应:A(s)+2B(g) C(g)+D(g)。下列哪些物理量不再发生变化时,表明该反应已达到平衡状态( )①混合气体的密度 ②混合气体的压强 ③A的质量 ④气体的总物质的量 ⑤混合气体的平均相对分子质量
A、①②③ B、②③⑤ C、①③⑤ D、①③④⑤14. 山梨酸的结构如图所示,下列有关山梨酸的叙述错误的是( ) A、分子式为 B、分子中所有的原子共平面 C、一定条件下能发生取代反应、加成反应和氧化反应 D、1mol山梨酸分别与足量的Na、溶液反应,相同状况下产生气体的体积不同15. 根据下列实验操作和现象,所得到的结论正确的是( )
A、分子式为 B、分子中所有的原子共平面 C、一定条件下能发生取代反应、加成反应和氧化反应 D、1mol山梨酸分别与足量的Na、溶液反应,相同状况下产生气体的体积不同15. 根据下列实验操作和现象,所得到的结论正确的是( )选项
实验操作和现象
结论
A
向鸡蛋清溶液中加入少量溶液,出现浑浊
蛋白质发生了变性
B
向蔗糖溶液中加入少量稀硫酸,加热,再加入银氨溶液,水浴加热,未出现银镜
蔗糖未水解
C
过量铜与稀硝酸充分反应后,再滴加稀硫酸,铜继续溶解
铜可以与稀硫酸反应
D
甲烷与氯气在光照下反应后的混合气体能使湿润的蓝色石蕊试纸变红
甲烷的氯取代物具有酸性
A、A B、B C、C D、D16. 利用甲烷可消除的污染:。在1 L密闭容器中,控制不同温度,分别加入和 , 测得随时间变化的有关实验数据见表。组别
温度
0
10
20
40
50
①
0.50
0.35
0.25
0.10
0.10
②
0.50
0.30
0.18
0.15
下列说法正确的是( )
A、组别①中,内,的消耗速率为 B、由实验数据可知实验控制的温度: C、时,表格中对应的数据为0.18 D、内,组别②中的转化率:25%17. 连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如下:
下列说法错误的是( )
A、反应1说明酸性:H2SO3>H2CO3 B、反应1结束后,可用盐酸酸化的 BaCl2溶液检验NaHSO3是否被氧化 C、反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2 D、反应2最好在无氧条件下进行18. 一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为:。该装置工作时,下列叙述正确的是( ) A、Al电极区的电极反应式: B、Al为正极 C、每消耗27gAl,有通过溶液转移到石墨电极上 D、若采用“食盐水+NaOH溶液”作电解质溶液,电极反应式相同19. 短周期元素X、Y、Z的原子序数依次增加,r与q是由这些元素组成的二元化合物,n、p、m分别是元素X、Y、Z的单质,m通常为黄绿色气体,r与q生成s的反应产生白烟。下列说法正确的是( )
A、Al电极区的电极反应式: B、Al为正极 C、每消耗27gAl,有通过溶液转移到石墨电极上 D、若采用“食盐水+NaOH溶液”作电解质溶液,电极反应式相同19. 短周期元素X、Y、Z的原子序数依次增加,r与q是由这些元素组成的二元化合物,n、p、m分别是元素X、Y、Z的单质,m通常为黄绿色气体,r与q生成s的反应产生白烟。下列说法正确的是( ) A、可用直接加热s的方法制q B、r的热稳定性比强 C、元素Z的含氧酸均为强酸 D、q不易液化20. 要除去下列物质中所含有的少量杂质,所选用的试剂和方法错误的是( )
A、可用直接加热s的方法制q B、r的热稳定性比强 C、元素Z的含氧酸均为强酸 D、q不易液化20. 要除去下列物质中所含有的少量杂质,所选用的试剂和方法错误的是( )序号
物质
杂质
试剂
方法
A
蒸馏
B
、浓
加热
C
NaOH溶液
洗气
D
饱和溶液
洗气
A、A B、B C、C D、D二、填空题
-
21. 海洋是生命的摇篮,浩瀚的海洋中蕴藏着丰富的资源。人们可以从海水中提取淡水和制得一些重要的化工产品。从海水提溴工艺流程如下图所示:
 (1)、工业上通过制备Mg,常用的冶炼方法是。通入热空气吹出 , 利用了溴的 (填序号)。
(1)、工业上通过制备Mg,常用的冶炼方法是。通入热空气吹出 , 利用了溴的 (填序号)。A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2)、写出吸收塔中反应的离子方程式。(3)、某同学提出,证明溴化氢溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由。(4)、蒸馏塔在蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因。(5)、从海水中获得淡水的主要方法有电渗析法、离子交换法和 (填一种)。离子交换法净化水的过程如图所示。下列说法正确的是 (填序号)。
A.经过阳离子交换树脂后,水中阳离子总数减少
B.通过阴离子交换树脂后,水中只有被除去
C.通过净化处理后的水,导电性增强
D.阴离子交换树脂填充段存在反应:
22. 硫元素和氨元素在化学实验、化工生产中扮演着重要角色。(1)、I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
图2中N所对应图1中物质的化学式为 , Y与金属铜反应所得产物的化学式为。X与Z反应中氧化剂与还原剂的物质的量之比为。
(2)、碳和M的浓溶液反应生成Z的化学方程式为。(3)、从分类角度分析判断,下列物质不属于酸性氧化物的是____。A、 B、 C、 D、(4)、II.氮及其化合物在很多方面有广泛应用。实验室常用与制取氨气。证明氨气已集满的操作和现象是。
(5)、含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
请回答:
①根据下图判断,使用亚硝化菌的最佳条件为。

②利用微生物处理含氮废水的优点为。(答出2点即可)。
(6)、汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式。23. 我国提出争取在2060年实现碳中和,这对于改善环境,实现绿色发展至关重要。将转化为甲烷或甲醇有助于碳中和的实现。(1)、科学家们经过探索实践,建立了如图所示的新循环体系:
根据上图分析,下列相关说法错误的是____。
A、化学变化中质量和能量都是守恒的 B、和H2生成甲烷的反应中原子利用率为100% C、将还原为甲醇能有效促进“碳中和” D、无机物和有机物可以相互转化(2)、在容积为2L的恒温密闭容器中,充入1mol和3mol , 一定条件下发生反应 , 测得和的物质的量随时间的变化情况如下表。时间
0min
3min
6min
9min
12min
0
0.50
0.65
0.75
0.75
1
0.50
0.35
a
0.25
①下列说法正确的是。
A.反应达到平衡后,反应不再进行
B.使用催化剂可以增大反应速率,提高生产效率
C.改变条件,可以100%转化为
D.通过调控反应条件,可以提高该反应进行的程度
②a=;3~6min内,。
③第3min时(填“>”“<”或“=”)第9min时。
(3)、某种甲烷燃料电池的工作原理如图所示。
通入甲烷的一极为电源的极,该电极反应式。当电路中累计有2mol电子通过时,理论上消耗氧气的体积为(在标准状况下)L。
24. 烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,B、D是生活中两种常见的有机物,E是一种有水果香味的物质。A可发生如下图所示的一系列化学反应。
请回答下列问题:
(1)、B的官能团名称是 , G的名称是。(2)、F是一种高分子化合物,其结构简式是。(3)、反应②的方程式为:。(4)、实验室常用图装置制取E。
该反应的化学方程式为。球形干燥管的作用是。
(5)、工业上用A和D直接反应制取E,其反应类型是 , 与(4)中实验室制法相比,该合成方法的优点是。