陕西省宝鸡市陈仓区2021-2022学年高一下学期期末考试化学试题
试卷更新日期:2022-08-01 类型:期末考试
一、单选题
-
1. 新型有机材料以独特的结构和性能在各个领域发挥重要作用。下列材料中主要成分不属于有机物的是( )




A.用作锂电池电解液的碳酸丙烯酯
B.口罩用聚丙烯熔喷布
C.“飞扬”火炬的碳纤维外壳
D.1211(二氟一氯一溴甲烷)灭火器
A、A B、B C、C D、D2. 当今环境污染已成为人类面临的重大威胁,下列对应关系不完全正确的是( )A、酸雨——SO2、NO2、CO2等 B、光化学烟雾——NO2、CxHy等 C、温室效应——CO2、CH4等 D、白色污染——各种颜色的难降解的塑料膜、塑料袋等3. 2022年4月16日,神舟十三号载人飞船返回舱在东风着陆场成功着陆。神舟十三飞船使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )A、煤油的分馏、裂化、裂解均为物理变化 B、相同质量的月壤中的3He与地球上的3H具有相同的电子数 C、陨石中的20Ne质子数与中子数相同 D、相同物质的量的氢气液态时燃烧放出热量大于气态燃烧释放的热量4. 下列有关化学用语,使用正确的是( )A、氯原子的原子结构示意图: B、NH4Cl的电子式:
B、NH4Cl的电子式: C、原子核内有10个中子的氧原子:
D、聚乙烯的结构简式:CH2=CH2
5. 下面关于化学反应的限度的叙述中,正确的是( )A、化学反应的限度都相同 B、可以通过改变温度控制化学反应的限度 C、可以通过延长化学反应的时间改变化学反应的限度 D、当一个化学反应在一定条件下达到限度时,反应即停止6. 把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是( )
C、原子核内有10个中子的氧原子:
D、聚乙烯的结构简式:CH2=CH2
5. 下面关于化学反应的限度的叙述中,正确的是( )A、化学反应的限度都相同 B、可以通过改变温度控制化学反应的限度 C、可以通过延长化学反应的时间改变化学反应的限度 D、当一个化学反应在一定条件下达到限度时,反应即停止6. 把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A、①④ B、③④ C、①③ D、②③7. 锌-空气电池具有蓄电量大、循环次数多等优点。下列说法正确的是( ) A、电池放电时,电极逐渐溶解 B、石墨为负极 C、电子由石墨经导线流向片 D、电池放电时,实现了电能向化学能的转化8. 下列有关苯的叙述中,错误的是( )A、苯在催化剂作用下能与液溴发生取代反应 B、在一定条件下,苯能与氢气发生加成反应 C、在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 D、在苯中加入溴水,振荡并静置后下层液体为红棕色9. 下列说法正确的是( )A、
A、电池放电时,电极逐渐溶解 B、石墨为负极 C、电子由石墨经导线流向片 D、电池放电时,实现了电能向化学能的转化8. 下列有关苯的叙述中,错误的是( )A、苯在催化剂作用下能与液溴发生取代反应 B、在一定条件下,苯能与氢气发生加成反应 C、在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 D、在苯中加入溴水,振荡并静置后下层液体为红棕色9. 下列说法正确的是( )A、 和
和 为同一物质
B、C5H12的一氯代物有7种
C、HCOOCH3和CH3OCHO互为同分异构体
D、C6H14的同分异构体有4种,其熔点各不相同
10. 下列四种有机物的分子式都是C4H10O,其中不能被氧化为相同碳原子数醛的是( )
为同一物质
B、C5H12的一氯代物有7种
C、HCOOCH3和CH3OCHO互为同分异构体
D、C6H14的同分异构体有4种,其熔点各不相同
10. 下列四种有机物的分子式都是C4H10O,其中不能被氧化为相同碳原子数醛的是( ) A、①和② B、①和④ C、③和④ D、②和③11. 某有机物的结构简式为
A、①和② B、①和④ C、③和④ D、②和③11. 某有机物的结构简式为 , 下列关于该有机物的叙述中,错误的是( ) A、能与金属钠发生反应并放出氢气 B、能在催化剂作用下与发生加成反应 C、不能使酸性溶液褪色 D、在铜作催化剂的条件下能发生催化氧化反应生成醛12. 乙酸分子的结构式如下,下列反应及断键部位正确的是( )
, 下列关于该有机物的叙述中,错误的是( ) A、能与金属钠发生反应并放出氢气 B、能在催化剂作用下与发生加成反应 C、不能使酸性溶液褪色 D、在铜作催化剂的条件下能发生催化氧化反应生成醛12. 乙酸分子的结构式如下,下列反应及断键部位正确的是( )
①乙酸的电离,是a键断裂
②乙酸与乙醇发生酯化反应,是b键断裂
③在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2CH2Br—COOH+HBr,是c键断裂
④乙酸变成乙酸酐的反应:2CH3COOH→
 +H2O,是ab键断裂A、①② B、①②③④ C、②③④ D、①③④13. 金属K与Na金属性相近,用K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:
+H2O,是ab键断裂A、①② B、①②③④ C、②③④ D、①③④13. 金属K与Na金属性相近,用K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:K
Na
KCl
NaCl
熔点/℃
63.65
97.8
770
801
沸点/℃
774
882.9
1500(升华)
1431
根据平衡移动原理可推知,用Na与KCl反应制K的适宜温度是( )
A、97.8~770℃ B、770~774℃ C、774~882.9℃ D、1413~1500℃14. 以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O22Cu+SO2。下列说法错误的是( )A、化合价发生变化的元素有3种 B、Cu2S在该反应中既是氧化剂又是还原剂 C、1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol D、SO2被分离、回收后氧化生成SO3 , 作为制取硫酸的原料15. 市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣服的汗渍、血液及人体排放的蛋白质油渍遇到它,皆能水解除去。下列衣料中不能用加酶洗衣粉洗涤的是( )①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥锦纶织品
A、①②③④⑤⑥ B、②④ C、③④⑤ D、③⑤⑥二、综合题
-
16. 元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:
 (1)、⑧所对应的元素名称为 , 其在周期表中的位置。(2)、在①~⑨元素中,原子半径最大的是(填元素符号),其某种氧化物可用于呼吸面具中氧气来源,请写出该反应化学方程式。(3)、比较④与⑨的气态氢化物的稳定性>(填化学式)。(4)、由下列元素形成的化合物中含有离子键的是____。A、①③ B、②③ C、①④ D、⑥⑨(5)、表中能形成两性氢氧化物的元素是(填写元素符号),写出该元素的氢氧化物与⑧最高价氧化物的水化物反应的化学方程式17. 甲烷的综合利用是各国科学家研究的重要课题。回答下列问题:(1)、天然气的主要成分是甲烷,甲烷的结构式为 , 甲烷的空间构型为。(2)、验证甲烷和氯气发生取代反应的条件,实验装置如图所示:
(1)、⑧所对应的元素名称为 , 其在周期表中的位置。(2)、在①~⑨元素中,原子半径最大的是(填元素符号),其某种氧化物可用于呼吸面具中氧气来源,请写出该反应化学方程式。(3)、比较④与⑨的气态氢化物的稳定性>(填化学式)。(4)、由下列元素形成的化合物中含有离子键的是____。A、①③ B、②③ C、①④ D、⑥⑨(5)、表中能形成两性氢氧化物的元素是(填写元素符号),写出该元素的氢氧化物与⑧最高价氧化物的水化物反应的化学方程式17. 甲烷的综合利用是各国科学家研究的重要课题。回答下列问题:(1)、天然气的主要成分是甲烷,甲烷的结构式为 , 甲烷的空间构型为。(2)、验证甲烷和氯气发生取代反应的条件,实验装置如图所示:
①装置A、B中的实验现象分别为、
②写出甲烷与氯气反应生成一氯甲烷的化学方程式:
③若将2mol与一定量的反应,得到等物质的量的4种取代物,则消耗的物质的量为。
18. 乙烯是一种重要化工原料,乙烯的产量可用来衡量一个国家的石油化工发展水平。请回答下列问题(1)、乙烯的结构式为 , 乙烯的空间构型为;(2)、将乙烯气体通入酸性高锰酸钾溶液中的现象为: , 乙烯可以在空气中燃烧,化学方程式为。(3)、在一定条件下,乙烯可以与H2、HCl、Cl2、H2O等物质发生反应。请写出乙烯与水反应的化学方程式。19. 乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请回答下列问题:(1)、乙醇分子的官能团名称为 , 小铭将足量乙醇与4.6g金属钠充分反应,则标准状况下生成气体的体积是L。(2)、小铭向一支试管中加3~5mL乙醇,再将下端绕成螺旋状的铜丝在酒精灯上灼烧至红热,插入乙醇中,反复几次。可观察到的现象是 , 该过程中发生的化学反应方程式为。20. 某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。回答下列问题: (1)、写出A的结构式:D的结构简式:;(2)、写出③反应的化学方程式 , 并注明反应类型;(3)、A可聚合生成高分子化合物,反应④的方程式为。21. 某种烃的衍生物分子式为C2H6O,下面是探讨其分子结构的过程,请回答相关问题:(1)、按价键理论,写出C2H6O可能有的结构式(用A、B、C……标明序号);(2)、取一定量的C2H6O与足量的金属钾反应,收集产生的气体,当完全反应时,C2H6O与产生的气体物质的量之比为2∶1。
(1)、写出A的结构式:D的结构简式:;(2)、写出③反应的化学方程式 , 并注明反应类型;(3)、A可聚合生成高分子化合物,反应④的方程式为。21. 某种烃的衍生物分子式为C2H6O,下面是探讨其分子结构的过程,请回答相关问题:(1)、按价键理论,写出C2H6O可能有的结构式(用A、B、C……标明序号);(2)、取一定量的C2H6O与足量的金属钾反应,收集产生的气体,当完全反应时,C2H6O与产生的气体物质的量之比为2∶1。①产生的气体能燃烧,火焰呈淡蓝色,燃烧产物通入无水硫酸铜,固体变蓝色;通入澄清石灰水,不变浑浊,则C2H6O与钾反应产生的气体是;
②据实验数据,可确定C2H6O的结构式为(写自编号) , 推断过程是。
22. 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)、步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是____;(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。A、烧杯 B、坩埚 C、表面皿 D、泥三角 E、酒精灯 F、干燥器(2)、步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。(3)、步骤⑤中,某学生选择用苯来提取碘的理由是(4)、请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:23. 小铭同学为了从海带浸取液中提取碘,设计了如图所示实验方案: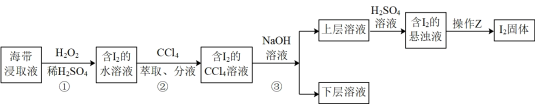 (1)、实验中操作Z的名称是 , 在步骤②萃取操作时需用到一种重要的玻璃仪器,其名称是(2)、步骤①发生的离子反应方程式为;(3)、步骤②用于提取碘的物质还可以是____A、乙醇 B、苯 C、乙酸 D、葡萄糖(4)、步骤③可通过反萃取法得到单质碘。向含碘的CCl4溶液中加入浓溶液,得到含的溶液,反应的离子方程式为。
(1)、实验中操作Z的名称是 , 在步骤②萃取操作时需用到一种重要的玻璃仪器,其名称是(2)、步骤①发生的离子反应方程式为;(3)、步骤②用于提取碘的物质还可以是____A、乙醇 B、苯 C、乙酸 D、葡萄糖(4)、步骤③可通过反萃取法得到单质碘。向含碘的CCl4溶液中加入浓溶液,得到含的溶液,反应的离子方程式为。三、计算题