江苏省宿迁市2021-2022学年高一下学期期末考试化学试题
试卷更新日期:2022-08-01 类型:期末考试
一、单选题
-
1. 2020年9月,中国在第75届联合国大会上提出2030年前碳达峰、2060年前碳中和目标。“碳中和”是指排放总量与吸收处理总量相等。下列措施不利于我国2060年实现“碳中和”自标的是( )A、加强化石燃料的开采使用 B、加强植树造林和荒漠绿化 C、加大风、光、水电的投资 D、加强新能源汽车推广使用2. 2020年12月17日,嫦娥五号顺利返回,我国探月工程圆满完成了“绕”“落”“回”三步走战略。发射火箭常采用无毒无污染的液氧、煤油作为燃料,下列说法错误的是( )A、氧气与煤油的反应是放热反应 B、煤油燃烧时,化学能全部转化为动能 C、工业上通过分离液态空气获得液氧 D、煤油燃烧后的主要产物是水和二氧化碳3. 下列表示正确的是( )A、N2的结构式: N≡N B、甲烷分子的球棍模型是:
 C、乙烯的结构简式:CH2CH2
D、NaCl的电子式:
C、乙烯的结构简式:CH2CH2
D、NaCl的电子式:  4. 下列物质的俗名与化学式相对应的是( )A、酒精—— B、胆矾—— C、纯碱—— D、铁红——5. 下列物质属于离子化合物且含有共价键的是( )A、 B、 C、 D、6. 下列说法错误的是( )A、和互为同位素 B、金刚石和石墨互为同素异形体 C、和互为同分异构体 D、与互为同系物7. 对于化学反应: , 下列措施(其他条件一定)不能增大反应速率的是( )
4. 下列物质的俗名与化学式相对应的是( )A、酒精—— B、胆矾—— C、纯碱—— D、铁红——5. 下列物质属于离子化合物且含有共价键的是( )A、 B、 C、 D、6. 下列说法错误的是( )A、和互为同位素 B、金刚石和石墨互为同素异形体 C、和互为同分异构体 D、与互为同系物7. 对于化学反应: , 下列措施(其他条件一定)不能增大反应速率的是( )①增大溶液的浓度 ②粉碎固体 ③升高反应体系的温度
④减小反应体系的压强 ⑤加入饱和食盐水 ⑥增加固体质量
A、①②③ B、②⑤ C、③⑥ D、④⑤⑥8. 用下列装置制取NH3 , 并还原CuO,其原理和装置均正确的是( )A、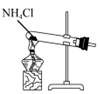 用装置制取NH3
B、
用装置制取NH3
B、 用装置干燥NH3
C、
用装置干燥NH3
C、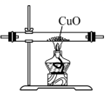 用装置还原CuO
D、
用装置还原CuO
D、 用装置处理尾气
9. 氢氧酸性燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关氢氧燃料电池的说法正确的是( )
用装置处理尾气
9. 氢氧酸性燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关氢氧燃料电池的说法正确的是( )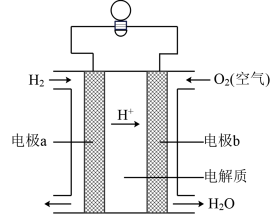 A、该电池中电极b是正极,发生的电极反应式为 B、外电路中电流由电极b通过导线流向电极a C、该电池工作过程中电解质溶液pH保持不变 D、该电池工作时电能转化为化学能10. 反应的能量变化如图所示,下列说法正确的是( )
A、该电池中电极b是正极,发生的电极反应式为 B、外电路中电流由电极b通过导线流向电极a C、该电池工作过程中电解质溶液pH保持不变 D、该电池工作时电能转化为化学能10. 反应的能量变化如图所示,下列说法正确的是( ) A、该正反应为吸热反应 B、该反应物总能量低于生成物总能量 C、吸热反应一定要加热后才能发生 D、、生成 , 共放出能量11. 金属铁和铝以及其相关制品在生活和生产中随处可见,用途十分广泛,如在电子、汽车、工业等领域也有各种各样的用途。工业上常利用铝热反应原理来焊接钢轨,化学方程式为:。下列物质性质与应用对应关系正确的是( )A、呈红棕色,可用于制作颜料 B、硅有导电性,可用作半导体材料和光导纤维 C、溶液呈酸性,可用于蚀刻印刷电路板 D、铁和铝都是活泼金属,工业上都用电解法来制备12. 金属铁和铝以及其相关制品在生活和生产中随处可见,用途十分广泛,如在电子、汽车、工业等领域也有各种各样的用途。工业上常利用铝热反应原理来焊接钢轨,化学方程式为:。可用于消毒净水,其制备反应为。下列说法正确的是( )A、是还原剂 B、被还原 C、发生氧化反应 D、是还原产物13. 金属铁和铝以及其相关制品在生活和生产中随处可见,用途十分广泛,如在电子、汽车、工业等领域也有各种各样的用途。工业上常利用铝热反应原理来焊接钢轨,化学方程式为:。下列关于铝及其化合物说法正确的是( )A、铝在常温下不能与氧气发生反应 B、铝制品有致密的氧化膜,可长时间盛放酸性或碱性食物 C、将氢氧化铝在高温下灼烧,即可得到氧化铝 D、等质量的铝分别与足量的盐酸和氢氧化钠溶液反应,放出的物质的量之比为3∶114. 在含有大量的、、的溶液中,还可能大量共存的离子是( )A、 B、 C、 D、15. 下列离子方程式书写正确的是( )A、向水中加入少量金属钠: B、与浓硝酸反应: C、双氧水与酸性的溶液反应: D、向溶液中滴加浓氨水至过量:16. 在给定的条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、17. 下列有机反应方程式书写正确的是( )A、乙烯与溴的加成反应: B、用苯乙烯合成聚苯乙烯:
A、该正反应为吸热反应 B、该反应物总能量低于生成物总能量 C、吸热反应一定要加热后才能发生 D、、生成 , 共放出能量11. 金属铁和铝以及其相关制品在生活和生产中随处可见,用途十分广泛,如在电子、汽车、工业等领域也有各种各样的用途。工业上常利用铝热反应原理来焊接钢轨,化学方程式为:。下列物质性质与应用对应关系正确的是( )A、呈红棕色,可用于制作颜料 B、硅有导电性,可用作半导体材料和光导纤维 C、溶液呈酸性,可用于蚀刻印刷电路板 D、铁和铝都是活泼金属,工业上都用电解法来制备12. 金属铁和铝以及其相关制品在生活和生产中随处可见,用途十分广泛,如在电子、汽车、工业等领域也有各种各样的用途。工业上常利用铝热反应原理来焊接钢轨,化学方程式为:。可用于消毒净水,其制备反应为。下列说法正确的是( )A、是还原剂 B、被还原 C、发生氧化反应 D、是还原产物13. 金属铁和铝以及其相关制品在生活和生产中随处可见,用途十分广泛,如在电子、汽车、工业等领域也有各种各样的用途。工业上常利用铝热反应原理来焊接钢轨,化学方程式为:。下列关于铝及其化合物说法正确的是( )A、铝在常温下不能与氧气发生反应 B、铝制品有致密的氧化膜,可长时间盛放酸性或碱性食物 C、将氢氧化铝在高温下灼烧,即可得到氧化铝 D、等质量的铝分别与足量的盐酸和氢氧化钠溶液反应,放出的物质的量之比为3∶114. 在含有大量的、、的溶液中,还可能大量共存的离子是( )A、 B、 C、 D、15. 下列离子方程式书写正确的是( )A、向水中加入少量金属钠: B、与浓硝酸反应: C、双氧水与酸性的溶液反应: D、向溶液中滴加浓氨水至过量:16. 在给定的条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、17. 下列有机反应方程式书写正确的是( )A、乙烯与溴的加成反应: B、用苯乙烯合成聚苯乙烯: C、苯的硝化反应:
C、苯的硝化反应:
 +H2O
D、合成乙酸乙酯:
18. 下图是某有机物分子的球棍模型。关于该物质的说法错误的是( )
+H2O
D、合成乙酸乙酯:
18. 下图是某有机物分子的球棍模型。关于该物质的说法错误的是( ) A、能与醋酸发生酯化反应 B、不能用于萃取碘水中的单质碘 C、能与金属钠反应生成氢气 D、能使紫色石蕊试液变红色19. 下列关于有机物的说法正确的是( )A、医用酒精为无水乙醇 B、苯可以使酸性高锰酸钾溶液褪色 C、蛋白质能发生水解转化为氨基酸 D、乙烯与氯化氢加成得到氯乙烯20. 苹果酸分子的结构简式为
A、能与醋酸发生酯化反应 B、不能用于萃取碘水中的单质碘 C、能与金属钠反应生成氢气 D、能使紫色石蕊试液变红色19. 下列关于有机物的说法正确的是( )A、医用酒精为无水乙醇 B、苯可以使酸性高锰酸钾溶液褪色 C、蛋白质能发生水解转化为氨基酸 D、乙烯与氯化氢加成得到氯乙烯20. 苹果酸分子的结构简式为 , 下列说法正确的是( ) A、苹果酸属于烃 B、苹果酸能发生氧化反应 C、苹果酸分子式为 D、苹果酸可与发生反应21. 糖类、油脂和蛋白质是维持人体生命活动的三大营养物质。下列有关说法正确的是( )A、三大营养物质均属于天然高分子化合物 B、所有的糖和油脂都可发生水解反应 C、糖类均有甜味,均易溶于水 D、油脂在酸性和碱性条件下都可发生水解反应22. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列氮及其化合物的性质与用途具有对应关系的是( )A、N2不溶于水,可用作保护气 B、NH3具有还原性,可用作制冷剂 C、KNO3具有氧化性,可用于制黑火药 D、NH4Cl受热易分解,可用于制造化肥23. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为。生产硝酸的尾气中主要含有、等大气污染物,可用石灰乳等碱性溶液吸收处理,并得到、等化工产品。对于反应 , 下列有关说法正确的是( )A、在恒温恒容条件下,若反应体系压强不再改变,说明该反应达到平衡状态 B、反应中生成时,转移电子 C、断裂键的同时,形成键,说明该反应达到平衡状态 D、若与足量的充分反应,则可以生成24. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为。生产硝酸的尾气中主要含有、等大气污染物,可用石灰乳等碱性溶液吸收处理,并得到、等化工产品。用石灰乳吸收硝酸工业的尾气(含、)可获得 , 其部分工艺流程如下:
, 下列说法正确的是( ) A、苹果酸属于烃 B、苹果酸能发生氧化反应 C、苹果酸分子式为 D、苹果酸可与发生反应21. 糖类、油脂和蛋白质是维持人体生命活动的三大营养物质。下列有关说法正确的是( )A、三大营养物质均属于天然高分子化合物 B、所有的糖和油脂都可发生水解反应 C、糖类均有甜味,均易溶于水 D、油脂在酸性和碱性条件下都可发生水解反应22. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列氮及其化合物的性质与用途具有对应关系的是( )A、N2不溶于水,可用作保护气 B、NH3具有还原性,可用作制冷剂 C、KNO3具有氧化性,可用于制黑火药 D、NH4Cl受热易分解,可用于制造化肥23. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为。生产硝酸的尾气中主要含有、等大气污染物,可用石灰乳等碱性溶液吸收处理,并得到、等化工产品。对于反应 , 下列有关说法正确的是( )A、在恒温恒容条件下,若反应体系压强不再改变,说明该反应达到平衡状态 B、反应中生成时,转移电子 C、断裂键的同时,形成键,说明该反应达到平衡状态 D、若与足量的充分反应,则可以生成24. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为。生产硝酸的尾气中主要含有、等大气污染物,可用石灰乳等碱性溶液吸收处理,并得到、等化工产品。用石灰乳吸收硝酸工业的尾气(含、)可获得 , 其部分工艺流程如下:
下列说法错误的是( )
A、将石灰乳改为澄清石灰水吸收效率将会增大 B、吸收时主要反应的化学方程式为 C、该工艺流程中生产出的中常会混有杂质 D、若尾气中 , 吸收后排放的气体中含量升高25. 根据实验目的,下列操作、现象及结论都正确的是( )选项
目的
操作及现象
结论
A
区别蛋白质的盐析与变性
向鸡蛋清的溶液中加入饱和硫酸铵溶液,产生白色沉淀,加水后沉淀消失
蛋白质变性
B
检验补铁口服液中是否含有
加入溶液无明显现象,再滴加少量氯水,溶液立即变为红色
含有
C
检验与的反应能否完全进行到底
向溶液中滴入溶液5~6滴,加振荡,静置后取上层清液滴加溶液,溶液变红
与的反应有一定限度
D
判断淀粉是否水解
向淀粉溶液中加入少量稀硫酸,加热,再加入银氨溶液,未出现银镜
淀粉未水解
A、A B、B C、C D、D26. 铝土矿的主要成分是 , 还有部分、 , 以及少量不溶于酸碱溶液的其它杂质,工业上从铝土矿中提取铝可采取如下工艺流程:
已知:是难溶于水的酸性氧化物,下列说法中正确的是( )
A、①~⑤中,属于氧化还原反应的是①⑤ B、沉淀Ⅰ是和少量不溶于酸碱溶液的其它杂质 C、溶液Ⅱ中含有的阴离子只有 D、生成沉淀Ⅲ的离子方程式为二、多选题
-
27. 某温度下,在2L恒容密闭容器中投入一定量的A、B,发生反应:3A(g)+bB(g)⇌cC(g)+2D(s),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中错误的是( )
 A、12s时,A的转化率为75% B、0-2s,D的平均反应速率为0.1mol/(L·s) C、化学计量系数之比b:c=1:2 D、图中两曲线相交时,A的消耗速率等于A的生成速率
A、12s时,A的转化率为75% B、0-2s,D的平均反应速率为0.1mol/(L·s) C、化学计量系数之比b:c=1:2 D、图中两曲线相交时,A的消耗速率等于A的生成速率三、填空题
-
28. 乳酸有很强的防腐保鲜功效,常用于食品工业。
 (1)、乳酸中含有的官能团是和。(填名称)(2)、写出足量的金属钠与乳酸反应的化学方程式:(3)、写出乳酸与乙醇在浓硫酸加热条件下反应的化学方程式:。
(1)、乳酸中含有的官能团是和。(填名称)(2)、写出足量的金属钠与乳酸反应的化学方程式:(3)、写出乳酸与乙醇在浓硫酸加热条件下反应的化学方程式:。四、实验题
-
29. 某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(),并对其进行纯度测定和相关性质的实验。

已知:
①;
②是白色固体,易被氧化。
(1)、生产过程中,从底部通入,硝酸从顶部以雾状喷下,其目的是。(2)、写出“还原”步骤中生成反应的离子方程式。(3)、若使“吸收”步骤中、完全转化为 , 则理论上“还原”步中与的物质的量之比为。(4)、该课外兴趣小组对实验制取的晶体进行纯度测定:a.称取2.000g样品,将其配成250mL溶液
b.先向锥形瓶内加入的溶液,加热至40~50℃,冷却后再向其中加入溶液,充分混合。
c.最后用待测的样品溶液与锥形瓶内溶液恰好完全反应,重复三次,平均每次消耗样品溶液40.00mL。(未配平)
求晶体的纯度,请写出计算过程。
-
-