河南省林州市2021-2022学年高一下学期期末考试化学试题
试卷更新日期:2022-08-01 类型:期末考试
一、单选题
-
1. 化学与科技、环境、生活等密切相关。下列说法错误的是( )A、为预防新冠肺炎的传播,可用次氯酸钠溶液对环境消毒 B、绿色化学的核心是应用化学原理对环境污染进行治理 C、神舟宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料 D、“复兴号”车厢连接处关键部位使用的增强聚四氟乙烯板属于有机高分子材料2. 硫酸是重要的化工原料,可用于生产化肥、农药、染料等。对于下列事实,括号中所写浓硫酸性质错误的是( )A、蔗糖中加入浓硫酸后出现发黑现象(脱水性) B、空气中敞口放置的浓硫酸质量分数变小(挥发性) C、浓硫酸在加热条件下与木炭反应(氧化性) D、浓硫酸可用来干燥某些气体(吸水性)3. 关于分子式为C2H6的烃A与分子式为C5H12的烃B,下列说法错误的是( )A、A与B一定互为同系物 B、A与B完全燃烧的产物相同 C、A与B分子中含有的-CH3个数一定相同 D、二者的化学性质相似4. 糖类、油脂和蛋白质是维持人体生命活动所必需的三大基本营养物质。下列叙述正确的是( )A、葡萄糖和蔗糖不互为同分异构体,但互为同系物 B、氢化植物油比普通植物油性质稳定 C、羊毛完全燃烧只生成CO2和H2O D、淀粉在稀硫酸作用下水解后,再加入新制Cu(OH)2 , 一定有砖红色沉淀产生5. 将2molX和2molY充入2L密闭容器中进行反应:X(g)+3Y(g)2Z(g)+aQ(g)。2min末该反应达到平衡时,生成了0.8molZ,测得Q的浓度为0.4mol/L。下列叙述错误的是( )A、a=2 B、0~2min内Y的反应速率为0.3mol/(L·min) C、平衡时Y的物质的量为0.8mol D、平衡时X的浓度为0.6mol/L6. 在一定条件下的恒容密闭容器中发生可逆反应2X(g)⇌Y(g)+Z(s),下列不能说明该反应达到化学平衡状态的是( )A、2v正(X)=v逆(Y) B、反应容器中Y的质量分数不变 C、体系压强不再变化 D、混合气体的密度不再变化7. 已知某药物具有抗痉挛作用,其结构简式为
 。下列说法错误的是( ) A、该物质能与金属钠作用 B、该物质能使溴水褪色 C、该物质能通过加聚反应形成有机高分子 D、该物质的分子式为8. 下列变化中,属于吸热反应的是( )A、过氧化钠和水的反应 B、干冰升华 C、盐酸和氢氧化钠的反应 D、灼热的木炭与CO2的反应9. “碳呼吸”电池原理如图所示,电解质溶液为含C2O的盐溶液,电池总反应为2Al+6CO2=Al2(C2O4)3。下列有关说法错误的是( )
。下列说法错误的是( ) A、该物质能与金属钠作用 B、该物质能使溴水褪色 C、该物质能通过加聚反应形成有机高分子 D、该物质的分子式为8. 下列变化中,属于吸热反应的是( )A、过氧化钠和水的反应 B、干冰升华 C、盐酸和氢氧化钠的反应 D、灼热的木炭与CO2的反应9. “碳呼吸”电池原理如图所示,电解质溶液为含C2O的盐溶液,电池总反应为2Al+6CO2=Al2(C2O4)3。下列有关说法错误的是( ) A、Al作负极 B、气体A中CO2含量比空气中低 C、负极反应式为2CO2+2e-=C2O D、每生成1molAl2(C2O4)3 , 消耗负极材料的质量为54g10. 下列关于硝酸的叙述正确的是( )A、NO2溶于水可生成硝酸,所以NO2是酸性氧化物 B、稀硝酸使滴有酚酞试液的NaOH溶液褪色,主要是因为稀硝酸具有强氧化性 C、浓硝酸放置一段时间后,颜色变黄 D、硝酸与铜的反应中,硝酸只表现出氧化性11. 已知反应:Si+2NaOH+H2O=Na2SiO3+2H2↑。将适量纯硅粉与纯钠按一定比例混合加入足量水中,固体恰好完全反应,转移电子0.3mol。硅与钠的质量比用X表示,收集到的气体体积为VL(标准状况下)。下列结果正确的是( )
A、Al作负极 B、气体A中CO2含量比空气中低 C、负极反应式为2CO2+2e-=C2O D、每生成1molAl2(C2O4)3 , 消耗负极材料的质量为54g10. 下列关于硝酸的叙述正确的是( )A、NO2溶于水可生成硝酸,所以NO2是酸性氧化物 B、稀硝酸使滴有酚酞试液的NaOH溶液褪色,主要是因为稀硝酸具有强氧化性 C、浓硝酸放置一段时间后,颜色变黄 D、硝酸与铜的反应中,硝酸只表现出氧化性11. 已知反应:Si+2NaOH+H2O=Na2SiO3+2H2↑。将适量纯硅粉与纯钠按一定比例混合加入足量水中,固体恰好完全反应,转移电子0.3mol。硅与钠的质量比用X表示,收集到的气体体积为VL(标准状况下)。下列结果正确的是( )选项
A
B
C
D
X
14∶23
1∶2
2∶1
14∶23
V
3.36
4.48
4.48
6.72
A、A B、B C、C D、D12. 下列化学方程式或离子方程式书写正确的是( )A、把稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ B、加热铜粉和硫粉的混合物:Cu+SCuS C、将浓硫酸滴在亚硫酸钠粉末上:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ D、硫酸氢钠溶液与氢氧化钡溶液混合呈中性:H++SO+Ba2++OH-=BaSO4↓+H2O13. 下列劳动与所涉及的化学知识不相符的是( )选项
劳动项目
化学知识
A
使用草木灰对蔬菜施肥
草木灰属钾肥
B
将浓硫酸放入分类储存、专人保管的安全柜中
浓硫酸有强腐蚀性
C
实验后,清洗仪器、处理费液、打扫卫生
废液随意排放会造成污染
D
使用“84”消毒液对衣物消毒
NaClO具有漂白性
A、A B、B C、C D、D14. 甲烷与水蒸气催化重整的反应为 , 其能量变化如下图所示。已知断裂键所需的能量是 , 则断裂键所需的能量是( ) A、 B、 C、 D、15. 利用如图所示装置(部分夹持装置略去)不能达到相应实验目的的是( )
A、 B、 C、 D、15. 利用如图所示装置(部分夹持装置略去)不能达到相应实验目的的是( ) A、利用装置Ⅰ制取乙烯 B、利用装置Ⅱ除去乙烯中的和 C、利用装置Ⅲ收集乙烯 D、利用装置Ⅳ验证乙烯的不饱和性16. 把3mol NO2气体依次通过 ①1L 1mol/L碳酸钠溶液 ②浓硫酸 ③足量Na2O2 的装置后(假设每一步的反应都是充分的),再用排水法收集残留气体,则收集到的气体是( )A、1molNO B、1molNO2和0.5molO2 C、0.25molO2 D、1/3mol NO17. 某温度时,浓度均为1mol·L-1的两种气体X2和Y2 , 在体积恒定的密闭容器中反应生成气体Z,4s时X2、Y2、Z的浓度分别是0.4mol·L-1、0.8mol·L-1、0.4mol·L-1 , 若Z用X、Y表示,则该反应的化学方程式可表示为( )A、X2+2Y22XY2 B、2X2+Y22X2Y C、3X2+Y22X3Y D、X2+3Y22XY318. 下列现象中,不是因为发生化学反应而褪色的是( )A、氯水久置变无色 B、乙烯使酸性高锰酸钾溶液褪色 C、乙烯使溴的四氯化碳溶液褪色 D、将苯滴入溴水中,振荡后水层接近无色19. 用的浓硫酸和铜共热一段时间后,待反应混合物冷却后倒入冷水中,滤去多余的铜,将滤液加水定容到 , 溶液中的浓度为 , 下列说法错误的是( )A、反应后为 B、反应中消耗的硫酸为 C、溶解的铜的质量为 D、生成的在标准状况下的体积为20. 现有10g分子中含有一个醇羟基的化合物A,与乙酸反应生成11.85g乙酸某酯,并回收了未反应的Al.3g,则A的相对分子质量为( )A、98 B、158 C、116 D、278
A、利用装置Ⅰ制取乙烯 B、利用装置Ⅱ除去乙烯中的和 C、利用装置Ⅲ收集乙烯 D、利用装置Ⅳ验证乙烯的不饱和性16. 把3mol NO2气体依次通过 ①1L 1mol/L碳酸钠溶液 ②浓硫酸 ③足量Na2O2 的装置后(假设每一步的反应都是充分的),再用排水法收集残留气体,则收集到的气体是( )A、1molNO B、1molNO2和0.5molO2 C、0.25molO2 D、1/3mol NO17. 某温度时,浓度均为1mol·L-1的两种气体X2和Y2 , 在体积恒定的密闭容器中反应生成气体Z,4s时X2、Y2、Z的浓度分别是0.4mol·L-1、0.8mol·L-1、0.4mol·L-1 , 若Z用X、Y表示,则该反应的化学方程式可表示为( )A、X2+2Y22XY2 B、2X2+Y22X2Y C、3X2+Y22X3Y D、X2+3Y22XY318. 下列现象中,不是因为发生化学反应而褪色的是( )A、氯水久置变无色 B、乙烯使酸性高锰酸钾溶液褪色 C、乙烯使溴的四氯化碳溶液褪色 D、将苯滴入溴水中,振荡后水层接近无色19. 用的浓硫酸和铜共热一段时间后,待反应混合物冷却后倒入冷水中,滤去多余的铜,将滤液加水定容到 , 溶液中的浓度为 , 下列说法错误的是( )A、反应后为 B、反应中消耗的硫酸为 C、溶解的铜的质量为 D、生成的在标准状况下的体积为20. 现有10g分子中含有一个醇羟基的化合物A,与乙酸反应生成11.85g乙酸某酯,并回收了未反应的Al.3g,则A的相对分子质量为( )A、98 B、158 C、116 D、278二、填空题
-
21. 燃煤的烟气中含有SO2 , 为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。(1)、“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是(填字母序号)。
a.石灰乳 b.CaCl2溶液
(2)、某工厂利用含SO2的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下: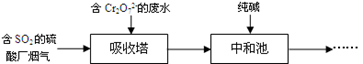
①用SO2处理含铬废水时,利用了SO2的性。
②吸收塔中发生反应的离子方程式为。
(3)、该废水经处理后,测得有关数据如下(其他离子忽略不计):离子
Cr2O72-
Cr3+
H +
Na +
SO42-
浓度(mol/L)
a
0.2×10-6
1.2×10-6
6.8×10-6
3.0×10-6
则a= 。
22. 氢能是发展中的新能源,它的利用包括氢的制备和储存。回答下列问题:(1)、图为碱性氢氧燃料电池的示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
①在导线中电子流动方向为(用a、b表示)
②正极反应式为。
(2)、氢氧燃料电池工作时,H2和O2连续由外部供给,因此,储氢是关键技术之一。①某些金属氢化物也可做储氢材料,在恒温恒容的密闭容器中,某储氢反应:达到化学平衡。下列有关叙述正确的是。
a.v(放氢)=v(吸氢)
b.吸收y mol H2只需1 mol MHx
c.若通入惰性气体Ar,压强增大,反应速率增大
d.容器内气体压强保持不变
②金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H22LiH
Ⅱ.LiH+H2O=LiOH+H2↑
用锂吸收224 L(标准状况)H2 , 生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为mol。
(3)、利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为。23. 硝酸是氧化性酸,其本质是NO有氧化性,某课外实验小组进行了有关NO氧化性的探究.查阅资料:活泼金属与1mol/L稀硝酸反应有H2和NH生成,NH生成的原理是产生H2的过程中NO被还原。实验装置如图所示:
编号
溶液X
实验现象
实验I
6mol/L稀硝酸
电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色
实验II
15mol/L浓硝酸
电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色
(1)、实验I中,铝片作(填“正”或“负”)极。液面上方产出红棕色气体的化学方程式是。(2)、实验II中电流计指针先偏向右边后偏向左边的原因是。(3)、若溶液X为1mol/L稀硝酸溶液,观察到电流计指针向右偏转,反应后的溶液中含有NH。生成NH的电极发生的反应是(填“氧化反应”或“还原反应”)(4)、进一步探究碱性条件下NO的氧化性,进行如图实验:
观察到A中有NH3生成,B中无明显现象,A、B产生不同现象的原因是。A中生成NH3的离子方程式是。
24. 一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质之一,一般不溶于水,也不溶于有机溶剂。有机物A~F之间的转化如图所示(图中部分产物已略去,且B生成C的同时还有CO2生成):
请回答下列问题:
(1)、由A生成B的化学方程式为。(2)、B、C中均含有的官能团的电子式为。(3)、从A转化为F的过程中发生反应的类型(填序号)①氧化反应 ②酯化反应 ③加成反应 ④水解反应
(4)、写出C→D发生反应的化学方程式。(5)、F有多种同分异构体,请写出其中与它具有相同官能团的所有同分异构体的结构简式:。