广东省深圳市2021-2022学年高一下学期期末考试化学试题
试卷更新日期:2022-08-01 类型:期末考试
一、单选题
-
1. 食品和药品关系着人的生存和健康。下列说法错误的是( )A、碳酸钠可用于治疗胃酸过多 B、蔬菜、粗粮中的纤维素有助于消化 C、氮气化学性质稳定,可用于食品保鲜 D、在食盐中添加 , 可为人体补充碘元素2. 一定条件下,和可合成乙烯:。下列有关说法错误的是( )A、、、互为同位素 B、的结构式: C、乙烯的球棍模型:
 D、的电子式:
3. 下列物质的应用中,利用了氧化还原反应的是( )A、用作供氧剂 B、用氧化铁作红色颜料 C、用盐酸去除铁锈(主要成分) D、用液氨作制冷剂4. 近日,国产大飞机C919首次飞行试验圆满完成。下列有关其材料的描述错误的是( )A、机身上的铝锂合金具有密度小、硬度大的优良性质 B、雷达罩上的玻璃纤维属于无机非金属材料 C、座舱显控系统中国产芯片的主要成分是硅单质 D、客机舱门上的芳纶材料属于天然高分子材料5. 东汉晚期的“青铜奔马”充分展示了我国光辉灿烂的古代科技。下列说法错误的是( )A、中为价 B、青铜属于铜合金 C、“青铜奔马”表面的铜绿[]属于碱 D、“曾青()得铁则化为铜”发生了置换反应6. 下列有关制取与处理的实验操作中正确的是( )
D、的电子式:
3. 下列物质的应用中,利用了氧化还原反应的是( )A、用作供氧剂 B、用氧化铁作红色颜料 C、用盐酸去除铁锈(主要成分) D、用液氨作制冷剂4. 近日,国产大飞机C919首次飞行试验圆满完成。下列有关其材料的描述错误的是( )A、机身上的铝锂合金具有密度小、硬度大的优良性质 B、雷达罩上的玻璃纤维属于无机非金属材料 C、座舱显控系统中国产芯片的主要成分是硅单质 D、客机舱门上的芳纶材料属于天然高分子材料5. 东汉晚期的“青铜奔马”充分展示了我国光辉灿烂的古代科技。下列说法错误的是( )A、中为价 B、青铜属于铜合金 C、“青铜奔马”表面的铜绿[]属于碱 D、“曾青()得铁则化为铜”发生了置换反应6. 下列有关制取与处理的实验操作中正确的是( )

碱石灰


稀硫酸
A.制备
B.干燥
C.收集
D.尾气吸收
A、A B、B C、C D、D7. 资源、能源、环保、安全等是当今社会重要的研究主题。下列有关说法错误的是( )A、通过石油裂解可以得到乙烯等重要的基本化工原料 B、将煤气化生成水煤气,实现了煤的清洁、高效利用 C、太阳能和风能对环境无污染,是理想的新能源 D、阿司匹林具有解热镇痛作用,可长期大量服用8. 劳动创造美好生活。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
工厂参观:自来水厂用氯气来杀菌、消毒
氯气为黄绿色气体
B
实验活动:用硝酸清洗银镜反应后的试管
硝酸具有较强的氧化性
C
农业活动:用熟石灰改良酸性土壤
是一种碱
D
社区服务:回收铝制易拉罐
再利用废旧金属,节约资源
A、A B、B C、C D、D9. 下列离子方程式书写正确的是( )A、和溶液反应: B、检验溶液中的: C、实验室制氯气: D、溶液与稀混合:10. 下列实验或生产过程及其解释均正确且有对应关系的是( )选项
实验或生产过程
解释
A
溶液蚀刻铜制印刷电路板
金属性:
B
和稀硝酸反应,在试管口有红棕色气体
和稀硝酸反应生成
C
新制的氯水长时间放置后,酸性增强
易分解产生
D
工业上通过电解熔融制取金属
熔点低
A、A B、B C、C D、D11. 富马酸二甲酯对霉菌有特殊的抑菌效果,可由富马酸制得:
下列说法错误的是( )
A、富马酸最多可与发生中和反应 B、富马酸中的所有碳原子共平面 C、富马酸二甲酯可使酸性溶液褪色 D、聚富马酸二甲酯的结构简式为 12. 某科研小组尝试利用固体表面催化工艺用制取乙炔(),用下图表示反应可能的微观历程。
12. 某科研小组尝试利用固体表面催化工艺用制取乙炔(),用下图表示反应可能的微观历程。
下列说法正确的是( )
A、过程中有非极性键的断裂 B、b、c、d中,c的能量最低 C、反应过程中碳元素化合价发生变化 D、上述反应原子利用率为100%13. 设为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,水中含有氢原子的数目为 B、常温常压下,所含有的分子数为 C、溶液中的数目为 D、重水()与水()中,中子数比为14. 一种可产生的锌一空气电池的工作原理如图(溶液作电解质溶液),下列说法正确的是( ) A、电流由流向复合碳电极 B、电解质溶液中的向复合碳电极方向移动 C、生成的电极反应式: D、消耗 , 理论上生成15. 下列除杂试剂选用不合理的是( )
A、电流由流向复合碳电极 B、电解质溶液中的向复合碳电极方向移动 C、生成的电极反应式: D、消耗 , 理论上生成15. 下列除杂试剂选用不合理的是( )选项
物质
杂质
除杂试剂
A
饱和溶液
B
溶液
足量铁粉
C
足量溶液
D
酸性溶液
A、A B、B C、C D、D16. 利用反应 , 可除去纯银饰品表面的 , 有关该反应下列说法错误的是( )A、氧化剂和还原剂物质的量之比为 B、和均为还原产物 C、每生成转移电子 D、若利用该反应设计原电池,则作负极17. 短周期元素W、X、Y、Z的原子序数依次增大,X与W、Z相邻,且X、Z同主族,W、X、Y、Z的最外层电子数之和为18,的金属性是短周期元素中最强的。下列说法正确的是( )A、原子半径: B、简单氢化物的稳定性: C、X、Y可形成一种离子化合物 D、Z的氧化物的水化物均为强酸18. 下列实验操作、现象和结论均正确的一组是( )选项
操作
现象
结论
A
将一块打磨过的铝片投入浓硝酸
铝片未见溶解
铝与浓硝酸不反应
B
向煮沸的溶液中滴入几滴饱和溶液,继续加热
溶液变成红褐色
制得胶体
C
用清净铂丝取待测液在酒精灯外焰灼烧
透过蓝色钴玻璃观察到紫色
溶液中含有
D
取少量淀粉水解液,加入溶液中和,再加入新制悬浊液,加热
产生砖红色沉淀
淀粉已完全水解
A、A B、B C、C D、D19. 物质的类别及其价态是认识物质的重要视角,下图为R元素的类价二维图,有关R元素的单质及其化合物说法错误的是( ) A、若R为N,则b生成a属于氮的固定 B、若R为S,则a与c反应生成黄色固体 C、若R为 , 则d的化学式可能为 D、c点对应的物质一定为酸性氧化物20. 一定温度,向体积固定的密闭容器中通入一定量的和 , 进行合成氨反应 , 反应过程中部分物质的物质的量随时间变化如图所示。
A、若R为N,则b生成a属于氮的固定 B、若R为S,则a与c反应生成黄色固体 C、若R为 , 则d的化学式可能为 D、c点对应的物质一定为酸性氧化物20. 一定温度,向体积固定的密闭容器中通入一定量的和 , 进行合成氨反应 , 反应过程中部分物质的物质的量随时间变化如图所示。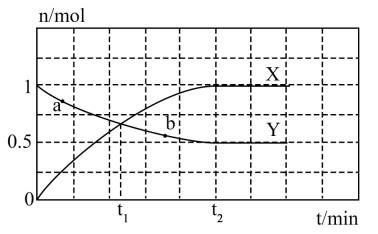
下列说法正确的是( )
A、Y表示的物质是 B、时刻, C、时刻,Y的转化率为33.3% D、a、b两点的正反应速率:二、综合题
-
21. 某同学利用下述装置制备并探究其与溶液的反应。
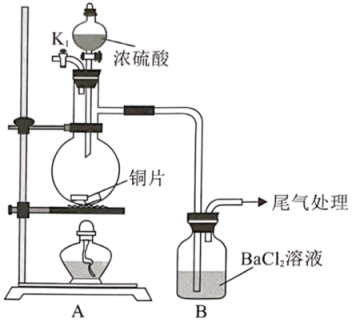
回答下列问题:
(1)、配制一定浓度的溶液所需玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管和。(2)、关闭 , 向蒸馏烧瓶内滴加浓硫酸,加热,蒸馏烧瓶中发生反应的化学方程式为。(3)、实验过程中,蒸馏烧瓶内出现白雾(硫酸酸雾),B中产生大量白色沉淀。通过(填操作名称)分离出B中沉淀于试管中,滴加(填试剂名称),沉淀不溶解,说明沉淀为而非。(4)、探究出现该沉淀的原因:假设Ⅰ:B溶液中的与、①(填化学式)反应生成
假设Ⅱ:酸雾进入B溶液中,与反应生成
假设Ⅲ:以上两种原因均存在
为证明以上假设,进行以下三组实验:
实验
B中现象
结论
实验一:打开 , 通入 , 一段时间后进行前述(2)中实验
出现白色沉淀
③假设(填“Ⅰ”“Ⅱ”或“Ⅲ”)最合理
实验二:在A和B之间连接一个洗气瓶,盛有②(填化学式)溶液。然后进行前述(2)中实验
出现白色沉淀
实验三:连接上述洗气瓶并通入 , 一段时间后进行前述(2)中实验
无沉淀
(5)、向溶解有的溶液中滴加下列溶液,能产生沉淀的有(填标号)。a、氨水 b、溴水 c、溶液 d、稀盐酸
22. 利用油脂厂废弃的镍()催化剂(主要含有、、及少量、、)制备的工艺流程如下:
回答下列问题:
(1)、为加快“碱浸”的速率可采取的措施是(任写一条);“碱浸”中的作用有:去除油脂、。(2)、“滤液2”中含金属阳离子,主要有:。(3)、①“转化”中反应的离子方程式是。②“转化”中可替代的最佳物质是(填标号)。
a、 b、 c、
(4)、某温度下,分解得到铁、氧质量比为的氧化物,其化学式为。23. 和是汽车尾气中污染大气的成分。一定条件下,通过下列转化反应:(放热反应),可治理和产生的污染。向体积相同的三个恒容密闭容器中均充入和进行下列实验:
实验序号
反应温度
催化剂
Ⅰ
恒温℃
无
Ⅱ
恒温℃
有
Ⅲ
初始温度℃,绝热容器
无
注:绝热容器的反应体系和外界环境无热交换
回答下列问题:
(1)、实验Ⅰ、Ⅱ中随时间t的变化曲线如下图,实验Ⅰ反应开始至平衡时间段内。平衡时的体积分数:实验Ⅰ实验Ⅱ(填“大于”“小于”或“等于”)。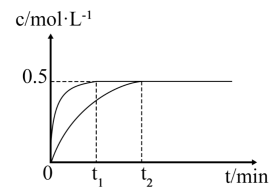 (2)、某时刻向实验Ⅱ容器充入一定量 , 使容器内压强增大。
(2)、某时刻向实验Ⅱ容器充入一定量 , 使容器内压强增大。①若X是 , 则反应速率(填“变大”“变小”或“不变”);
②若X是(不参与反应),则反应速率(填“变大”“变小”或“不变”)。
(3)、下列叙述能说明转化反应到达平衡状态的有____(填标号)。A、 B、断裂同时生成 C、的值不变 D、 E、气体的平均摩尔质量不变(4)、反应一段时间后,发现实验Ⅲ中反应速率增大,其原因是。(5)、转化反应 , 在的催化作用下反应历程可分为:第一步:;
第二步:+=+(将化学方程式补充完整)。
24. 巴豆酸甲酯常用于配制香料,一种合成该物质的路线如下:
回答下列问题:
(1)、A的名称为。(2)、反应②的反应类型为。(3)、E中官能团的名称为。(4)、反应⑥的化学方程式为。(5)、B的同系物G比B的相对分子质量大28,则G的同分异构体有种(不考虑立体异构),其中一种含有三个甲基的G的结构简式为。