北京市怀柔区2021-2022学年高一下学期期末化学试题
试卷更新日期:2022-08-01 类型:期末考试
一、单选题
-
1. 下列文物的主要材质属于非金属材料的是( )
A
B
C
D




铜奔马(马踏飞燕)
良渚玉琮
曾侯乙编钟
铜屏风构件
A、A B、B C、C D、D2. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、Na2CO3溶液 B、蔗糖溶液 C、Fe(OH)3 胶体 D、H2SO4 溶液3. 下列物质中,属于电解质的是( )A、H2 B、NaCl溶液 C、Cu D、H2SO44. 下列元素的原子半径最小的是( )A、F B、Al C、S D、Cl5. 下列物质中,含离子键的是( )A、NH3 B、CO2 C、NH4Cl D、Cl26. 下列分子中,一定含碳碳双键的是( )A、C2H4 B、C3H8 C、C2H5OH D、CH3COOH7. 下列化合物中与CH3CH2CH=CH2互为同分异构体的是( )A、CH2=CH2 B、CH3CH3 C、CH3CH=CHCH3 D、CH3CH2OH8. 下列关于氯气的说法正确的是( )A、常温下是无色气体 B、可用于自来水消毒 C、能使干燥的红色布条褪色 D、H2在Cl2中燃烧,火焰呈黄色9. 下列反应属于吸热反应的是( )A、甲烷在空气中燃烧 B、生石灰和水反应 C、锌粒与稀硫酸反应 D、石灰石在高温下分解反应10. 人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的铁粉,这些铁粉在人体胃酸(主要成分是HCl)作用下转化成亚铁盐。下列叙述错误的是( )A、铁粉具有还原性 B、铁是人体必需的微量元素 C、亚铁盐溶液呈浅绿色 D、Fe+2H+=Fe3++H2↑11. 下列元素中金属性最强的是( )A、Li B、Mg C、Al D、Na12. 中美科学家携手发现了全硼富勒烯B40团簇(如图结构),它在储氢储锂、半导体、超导、绿色催化等领域具有重要的应用。 B40属于( ) A、单质 B、化合物 C、有机物 D、氧化物13. 臭氧是理想的烟气脱硝剂,其脱硝反应为 2NO2(g)+O3(g)
A、单质 B、化合物 C、有机物 D、氧化物13. 臭氧是理想的烟气脱硝剂,其脱硝反应为 2NO2(g)+O3(g) N2O5(g)+O2(g)。有关说法正确的是( ) A、增大压强可增大反应速率 B、升高温度可减小反应速率 C、达到平衡时,v(正)=v(逆)=0 D、达到平衡时,NO2转化率为100%14. 相同质量的铁粉与足量稀硫酸分别在下列条件下发生反应,开始时反应速率最快的是( )
N2O5(g)+O2(g)。有关说法正确的是( ) A、增大压强可增大反应速率 B、升高温度可减小反应速率 C、达到平衡时,v(正)=v(逆)=0 D、达到平衡时,NO2转化率为100%14. 相同质量的铁粉与足量稀硫酸分别在下列条件下发生反应,开始时反应速率最快的是( )选项
A
20
1
B
20
2
C
40
1
D
40
2
A、A B、B C、C D、D15. (Y为钇元素)是磁悬浮列车中的重要超导材料,下列关于的说法中正确的是( )A、质量数是89 B、质量数是39 C、中子数是39 D、质子数是8916. 酒精和醋酸是日常生活中的常用品,下列方法不能将二者鉴别开的是( )A、闻气味 B、分别滴加石蕊溶液 C、分别滴加NaOH溶液 D、分别用来浸泡水壶中的水垢,观察水垢是否溶解17. 某粒子的结构示意图为 , 关于该粒子的说法错误的是( ) A、属于阴离子 B、核外有3个电子层 C、核外电子数为18 D、在化学反应中易得电子18. 下列物质的电子式书写正确的是( )A、
, 关于该粒子的说法错误的是( ) A、属于阴离子 B、核外有3个电子层 C、核外电子数为18 D、在化学反应中易得电子18. 下列物质的电子式书写正确的是( )A、 B、
B、 C、
C、 D、
D、 19. 下列反应属于加成反应的是( )A、甲烷和氯气光照条件下反应 B、乙烯使酸性高锰酸钾溶液褪色 C、乙烯使溴的四氯化碳溶液褪色 D、乙烷在空气中燃烧20. 下列操作符合化学实验安全要求的是( )A、向正在燃烧的酒精灯添加酒精 B、在点燃或加热可燃气体前检验其纯度,防止发生爆炸 C、将实验中产生的各种废液直接倾倒入下水道 D、实验中不慎将浓硫酸滴在皮肤上,立即用氢氧化钠溶液进行清洗21. 普洱熟茶的制作过程主要包括采摘、摊晾、杀青、揉捻、渥堆发酵、出堆解块等操作,下列普洱熟茶的制作过程中以化学反应为主的是( )A、摊晾
19. 下列反应属于加成反应的是( )A、甲烷和氯气光照条件下反应 B、乙烯使酸性高锰酸钾溶液褪色 C、乙烯使溴的四氯化碳溶液褪色 D、乙烷在空气中燃烧20. 下列操作符合化学实验安全要求的是( )A、向正在燃烧的酒精灯添加酒精 B、在点燃或加热可燃气体前检验其纯度,防止发生爆炸 C、将实验中产生的各种废液直接倾倒入下水道 D、实验中不慎将浓硫酸滴在皮肤上,立即用氢氧化钠溶液进行清洗21. 普洱熟茶的制作过程主要包括采摘、摊晾、杀青、揉捻、渥堆发酵、出堆解块等操作,下列普洱熟茶的制作过程中以化学反应为主的是( )A、摊晾 B、揉捻
B、揉捻 C、渥堆发酵
C、渥堆发酵 D、出堆解块
D、出堆解块 22. 下列说法中,正确的是( )A、Cu的摩尔质量是64 B、的体积一定是 C、中含有的分子数约为 D、溶液中含有23. 下列反应的离子方程式正确的是( )A、氢氧化钡溶液与硫酸溶液反应:Ba2+ + SO= BaSO4↓ B、氯化钠溶液与硝酸银溶液反应: C、碳酸钙与稀盐酸反应: D、稀硝酸与氢氧化钠溶液反应:24. 利用含硫物质热化学循环实现太阳能的转化与存储的过程如下图所示。下列说法中,错误的是 ( )
22. 下列说法中,正确的是( )A、Cu的摩尔质量是64 B、的体积一定是 C、中含有的分子数约为 D、溶液中含有23. 下列反应的离子方程式正确的是( )A、氢氧化钡溶液与硫酸溶液反应:Ba2+ + SO= BaSO4↓ B、氯化钠溶液与硝酸银溶液反应: C、碳酸钙与稀盐酸反应: D、稀硝酸与氢氧化钠溶液反应:24. 利用含硫物质热化学循环实现太阳能的转化与存储的过程如下图所示。下列说法中,错误的是 ( ) A、实现了将太阳能转化为电能 B、反应Ⅰ为放热反应 C、反应Ⅱ的化学方程式为 D、可循环使用25. 根据下列实验操作与现象得出的结论正确的是( )
A、实现了将太阳能转化为电能 B、反应Ⅰ为放热反应 C、反应Ⅱ的化学方程式为 D、可循环使用25. 根据下列实验操作与现象得出的结论正确的是( )选项
实验操作
现象
结论
A
向某溶液中滴加澄清石灰水
产生白色沉淀
该溶液中一定含
B
向品红溶液中通入某气体
溶液褪色
该气体一定为SO2
C
向某溶液中滴加淀粉溶液
溶液变为蓝色
该溶液中一定含I2
D
向某溶液中滴加硝酸银溶液
产生白色沉淀
该溶液中一定含Cl-
A、A B、B C、C D、D二、填空题
-
26. 补齐物质及其用途的连线。
物质
用途
A.乙烯————
a.植物生长调节剂
B.乙醇
b.红色颜料
C.过氧化钠
c.医用消毒剂
D.氧化铁
d.作供氧剂
27. 选择完成下列实验的装置。①
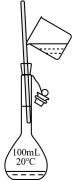 ②
② ③
③ (1)、除去水中的泥沙用(填序号,下同)。(2)、用NH4Cl和Ca(OH)2制取NH3 , 选用。(3)、配制100mL1.00mol·L-1NaCl溶液用。28. 为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应:2NO+2CON2+2CO2。(1)、作氧化剂的物质是。碳元素的化合价(填“升高”或“降低”)。(2)、若反应中产生了1molN2 , 则消耗NO的物质的量为mol,转移电子的物质的量为mol。29. 化学电池的发明,是贮能和供能技术的巨大进步。
(1)、除去水中的泥沙用(填序号,下同)。(2)、用NH4Cl和Ca(OH)2制取NH3 , 选用。(3)、配制100mL1.00mol·L-1NaCl溶液用。28. 为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应:2NO+2CON2+2CO2。(1)、作氧化剂的物质是。碳元素的化合价(填“升高”或“降低”)。(2)、若反应中产生了1molN2 , 则消耗NO的物质的量为mol,转移电子的物质的量为mol。29. 化学电池的发明,是贮能和供能技术的巨大进步。 (1)、图所示装置中,Zn片是(填“正极”或“负极”)。(2)、图所示装置可将(写离子反应方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是。(3)、下列反应通过原电池装置,可实现化学能直接转化为电能的是(填序号)。
(1)、图所示装置中,Zn片是(填“正极”或“负极”)。(2)、图所示装置可将(写离子反应方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是。(3)、下列反应通过原电池装置,可实现化学能直接转化为电能的是(填序号)。①2H2+O22H2O
②Cu+2Ag+=Cu2++2Ag
③NaOH+HCl=NaOH+H2O
30. 下表为元素周期表的一部分。碳
W
Y
X
硫
Z
回答下列问题:
(1)、X元素位于周期表的第周期。(2)、H2S的稳定性(填“>”或“<”)HZ。(3)、W元素原子的得电子能力弱于Y的原因是(请用元素符号作答)。(4)、Se是动植物体营养元素,位于周期表第四周期,与硫同主族。下列关于Se的推断中,正确的是:。a.原子半径:Se>S
b.Se最高价氧化物对应的水化物的酸性强于H2SO4
c.SeO2只具有氧化性
三、实验题
-
31. 某实验小组探究氯水与铁的反应。
 (1)、实验i中产生少量无色气体,该气体可能是(填写化学式)。(2)、实验ii中观察到溶液变为红色,可推知上层清液中含有。(3)、实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+ , 其原因是(用离子方程式表示)。(4)、某同学认为上层清液中的Fe3+是因为Fe2+被氧化,则可能的氧化剂为。32. 某小组同学欲探究H2O2的性质,过程如下:
(1)、实验i中产生少量无色气体,该气体可能是(填写化学式)。(2)、实验ii中观察到溶液变为红色,可推知上层清液中含有。(3)、实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+ , 其原因是(用离子方程式表示)。(4)、某同学认为上层清液中的Fe3+是因为Fe2+被氧化,则可能的氧化剂为。32. 某小组同学欲探究H2O2的性质,过程如下:【预测】
聚焦H2O2中的O作为核心元素,因此预测H2O2既具有氧化性,也具有还原性。
【实验和观察】
小组同学分别选用酸性KMnO4溶液、酸性KI溶液与5% H2O2溶液反应以验证预测。
实验①

实验②
 (1)、实验①利用了酸性高锰酸钾的(填“氧化性”或“还原性”),该实验中,证明酸性KMnO4溶液与H2O2溶液反应的现象除了溶液颜色变浅或褪色外,还有。(2)、实验②是为了验证H2O2的(填“氧化性”或“还原性”),在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式:。(3)、【解释和结论】
(1)、实验①利用了酸性高锰酸钾的(填“氧化性”或“还原性”),该实验中,证明酸性KMnO4溶液与H2O2溶液反应的现象除了溶液颜色变浅或褪色外,还有。(2)、实验②是为了验证H2O2的(填“氧化性”或“还原性”),在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式:。(3)、【解释和结论】以上实验可得出的结论是。
33. 阅读短文,回答问题。2022年冬奥会在北京举行,2022年北京冬奥会“飞扬”火炬主要分为外飘带、内飘带和氢气燃烧装置3个部分。
火炬“飞扬”的外飘带用碳纤维从经向、纬向、法向三个维度编织,然后与耐高温的第三代聚硅氮烷树脂形成碳纤维复合材料。专家评价“飞扬”具备轻、固、美的特点。
碳纤维还被应用于北京冬奥会的其他方面。雪车被称为“冰上F1”,是名副其实的冬奥会“速度之王”。为了让雪车车身材料质量更轻,强度更高,本次参会的中国选手驾驶的“中国红”国产雪车应用宇航级别的碳纤维复合材料。此外,碳纤维还被成功应用于奥运雪车头盔制作等。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)
(1)、火炬“飞扬”外飘带使用了复合材料。(2)、碳纤维复合材料密度小、强度高。(3)、冬奥会火炬使用的燃料为甲烷。(4)、火炬“飞扬”“固”的特点与使用三个维度编织法相关。34. “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2 , 得到亚硫酸钠(Na2SO3)粗品。其流程如下: (1)、为加快工业废碱渣中Na2CO3的溶解,可采取的措施是(写出一种即可)。(2)、过程①进行的操作是。(3)、上述流程中,加入NaOH后,发生反应的化学方程式为。(4)、亚硫酸钠粗品中含有少量Na2SO4 , 原因是。(5)、设计实验证明亚硫酸钠粗品含有少量Na2SO4的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, , 出现白色沉淀,则证明含有Na2SO4。
(1)、为加快工业废碱渣中Na2CO3的溶解,可采取的措施是(写出一种即可)。(2)、过程①进行的操作是。(3)、上述流程中,加入NaOH后,发生反应的化学方程式为。(4)、亚硫酸钠粗品中含有少量Na2SO4 , 原因是。(5)、设计实验证明亚硫酸钠粗品含有少量Na2SO4的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, , 出现白色沉淀,则证明含有Na2SO4。