安徽省阜阳市2021-2022学年高一下学期期末教学质量统测化学试题
试卷更新日期:2022-08-01 类型:期末考试
一、单选题
-
1. 《黄帝内经·素问》提出了“五谷为养,五果为助,五畜为益,五菜为充”饮食调养原则。下列说法正确的是( )A、“五菜”富含纤维素,纤维素属于多糖 B、“五谷”富含淀粉,淀粉的最终水解产物为蔗糖 C、“五畜”富含油脂和蛋白质,它们的水解产物相同 D、“五果”富含维生素,维生素属于无机物2. 汽车发生剧烈碰撞时,安全气囊发生的主要反应为。下列说法正确的是( )A、中只含有离子键 B、原子的结构示意图:
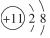 C、的电子式:
C、的电子式: D、分子中含有极性键
3. 下列酸的性质与用途具有对应关系的是( )A、盐酸具有挥发性,可用于除去铁锈 B、浓硫酸具有脱水性,可用于气体干燥 C、次氯酸具有弱酸性,可用作有色物质的漂白剂 D、硝酸具有强氧化性,可用于溶解一些不活泼金属4. 下列物质互为同分异构体的是( )A、与 B、乙烷()与丙烷() C、葡萄糖与果糖
D、分子中含有极性键
3. 下列酸的性质与用途具有对应关系的是( )A、盐酸具有挥发性,可用于除去铁锈 B、浓硫酸具有脱水性,可用于气体干燥 C、次氯酸具有弱酸性,可用作有色物质的漂白剂 D、硝酸具有强氧化性,可用于溶解一些不活泼金属4. 下列物质互为同分异构体的是( )A、与 B、乙烷()与丙烷() C、葡萄糖与果糖 D、乙烯()与聚乙烯
D、乙烯()与聚乙烯 5. 短周期主族元素X、Y、Z、W原子序数依次增大,X元素的最外层电子数是内层电子数的3倍,Y元素的原子半径是同周期主族元素中最大的,Z元素位于元素周期表IIIA族,W元素与X元素属于同一主族。下列说法正确的是( )A、原子半径: B、由X、Y组成的化合物均是离子化合物 C、X的简单气态氢化物的热稳定性比W的弱 D、Y、Z的最高价氧化物对应的水化物不能相互反应6. 海洋是一个巨大的资源宝库。从海水中能获得大量 , 通过化学反应可转化为、、、、、等。海水中含有丰富的碘元素,海洋中许多藻类植物具有富集碘的能力,如干海带中含碘量可达0.3%~0.5%。从海水(、、、)中还能提取镁。在给定条件下,下列物质间所示的转化可以实现的是( )A、 B、 C、 D、7. 海洋是一个巨大的资源宝库。从海水中能获得大量 , 通过化学反应可转化为、、、、、等。海水中含有丰富的碘元素,海洋中许多藻类植物具有富集碘的能力,如干海带中含碘量可达0.3%~0.5%。从海水(、、、)中还能提取镁。从干海带中可提取 , 下列实验原理与装置能达到相应实验目的的是( )
5. 短周期主族元素X、Y、Z、W原子序数依次增大,X元素的最外层电子数是内层电子数的3倍,Y元素的原子半径是同周期主族元素中最大的,Z元素位于元素周期表IIIA族,W元素与X元素属于同一主族。下列说法正确的是( )A、原子半径: B、由X、Y组成的化合物均是离子化合物 C、X的简单气态氢化物的热稳定性比W的弱 D、Y、Z的最高价氧化物对应的水化物不能相互反应6. 海洋是一个巨大的资源宝库。从海水中能获得大量 , 通过化学反应可转化为、、、、、等。海水中含有丰富的碘元素,海洋中许多藻类植物具有富集碘的能力,如干海带中含碘量可达0.3%~0.5%。从海水(、、、)中还能提取镁。在给定条件下,下列物质间所示的转化可以实现的是( )A、 B、 C、 D、7. 海洋是一个巨大的资源宝库。从海水中能获得大量 , 通过化学反应可转化为、、、、、等。海水中含有丰富的碘元素,海洋中许多藻类植物具有富集碘的能力,如干海带中含碘量可达0.3%~0.5%。从海水(、、、)中还能提取镁。从干海带中可提取 , 下列实验原理与装置能达到相应实验目的的是( )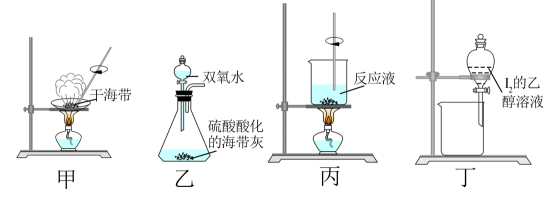 A、用装置甲灼烧海带 B、在装置乙中反应生成I2 C、用装置丙蒸发浓缩反应液 D、用装置丁萃取碘水中的8. 海洋是一个巨大的资源宝库。从海水中能获得大量 , 通过化学反应可转化为、、、、、等。海水中含有丰富的碘元素,海洋中许多藻类植物具有富集碘的能力,如干海带中含碘量可达0.3%~0.5%。从海水(、、、)中还能提取镁。模拟浓海水提取镁的实验流程如下图:
A、用装置甲灼烧海带 B、在装置乙中反应生成I2 C、用装置丙蒸发浓缩反应液 D、用装置丁萃取碘水中的8. 海洋是一个巨大的资源宝库。从海水中能获得大量 , 通过化学反应可转化为、、、、、等。海水中含有丰富的碘元素,海洋中许多藻类植物具有富集碘的能力,如干海带中含碘量可达0.3%~0.5%。从海水(、、、)中还能提取镁。模拟浓海水提取镁的实验流程如下图:
下列说法正确的是( )
A、产品1的成分是硫酸钙 B、酸化生成的离子反应为 C、电解无水氯化镁产生单质镁和氯气,该反应是放热反应 D、上述流程中元素的化合价没有发生改变9. 部分含硫物质的分类与相应化合价关系如图所示。下列说法合理的是( ) A、a可与c发生反应生成b B、b在过量氧气中燃烧生成d C、e溶液和g溶液都能与铜反应 D、h转化为f时,需加入还原剂10. 烃X是一种重要的化工原料,已知X在标准状况下的密度为。各有机物之间的转化关系如图所示,且W与Z反应能生成和下列说法正确的是( )
A、a可与c发生反应生成b B、b在过量氧气中燃烧生成d C、e溶液和g溶液都能与铜反应 D、h转化为f时,需加入还原剂10. 烃X是一种重要的化工原料,已知X在标准状况下的密度为。各有机物之间的转化关系如图所示,且W与Z反应能生成和下列说法正确的是( ) A、石蜡油→X的过程属于蒸馏 B、可以用溴的四氯化碳溶液鉴别X和W C、有机物W与Z都能与氢氧化钠溶液反应 D、有机物Y与Z中含有相同的官能团11. 实验室中在相同温度下对溶液中的分解速率影响因素进行研究,有关实验数据见下图。下列说法正确的是( )
A、石蜡油→X的过程属于蒸馏 B、可以用溴的四氯化碳溶液鉴别X和W C、有机物W与Z都能与氢氧化钠溶液反应 D、有机物Y与Z中含有相同的官能团11. 实验室中在相同温度下对溶液中的分解速率影响因素进行研究,有关实验数据见下图。下列说法正确的是( ) A、在0~20 min内,I中的分解速率为 B、水样酸性越强,的分解速率越慢 C、在0~25 min内,III中的分解百分率比II小 D、由于存在,IV中的分解速率比III快12. 燃料电池()是一种新型水下化学电源(质子交换膜只允许质子通过,不允许其他离子或分子通过)。下列说法正确的是( )
A、在0~20 min内,I中的分解速率为 B、水样酸性越强,的分解速率越慢 C、在0~25 min内,III中的分解百分率比II小 D、由于存在,IV中的分解速率比III快12. 燃料电池()是一种新型水下化学电源(质子交换膜只允许质子通过,不允许其他离子或分子通过)。下列说法正确的是( )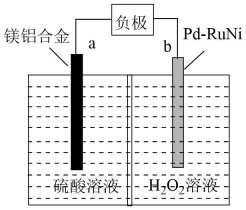 A、电池工作时,电能主要转化为化学能 B、电极a为电池的正极 C、电极b上会产生大量的气泡 D、电池工作时,H+通过交换膜从左到右移动13. 甲烷的光照实验如图所示。光照一段时间后,试管内液面上升,气体颜色逐渐变浅,试管内壁出现油状液滴,试管中出现了少量白雾。下列关于该实验的说法错误的是( )
A、电池工作时,电能主要转化为化学能 B、电极a为电池的正极 C、电极b上会产生大量的气泡 D、电池工作时,H+通过交换膜从左到右移动13. 甲烷的光照实验如图所示。光照一段时间后,试管内液面上升,气体颜色逐渐变浅,试管内壁出现油状液滴,试管中出现了少量白雾。下列关于该实验的说法错误的是( ) A、试管内液面上升原因之一是气体的物质的量减少 B、试管内壁出现了油状液滴,油状液滴成分属于混合物 C、收集试管中的白雾配成水溶液,该溶液显中性 D、由实验过程中产生的现象可推知,甲烷与氯气在光照条件下能发生取代反应14. 在工业上用途非常广泛,通过下列实验探究溶液的性质
A、试管内液面上升原因之一是气体的物质的量减少 B、试管内壁出现了油状液滴,油状液滴成分属于混合物 C、收集试管中的白雾配成水溶液,该溶液显中性 D、由实验过程中产生的现象可推知,甲烷与氯气在光照条件下能发生取代反应14. 在工业上用途非常广泛,通过下列实验探究溶液的性质实验l:将浓溶液滴入沸水中,分散系呈现红褐色
实验2:在装有少量溶液的试管中加入铜粉充分振荡,溶液由黄色变成蓝色
实验3:在装有少量溶液的试管中加入过量溶液,充分振荡后,分成两份:一份加入有机溶剂 , 振荡后层显紫红色;另一份加入溶液,溶液显红色
实验4:在装有少量溶液的试管中加入少量溶液,充分振荡后产生白色沉淀下列说法正确的是( )
A、实验1中的铁元素形成的粒子大小没有改变 B、实验2中发生反应的离子方程式为 C、实验3中与发生氧化还原反应,但反应存在限度 D、实验4静置后溶液中大量存在的离子有、、、二、填空题
-
15. 元素周期律的发现是近代化学史的里程碑,使化学的研究变得有规律可循。(1)、预测物质的性质。利用元素周期表的有关知识,判断下列对于铍及其化合物的性质的推测正确的是____(填字母)。A、单质铍能与冷水剧烈反应 B、氢氧化铍的碱性比氢氧化钙的碱性弱 C、氢氧化铍能与溶液发生反应 D、相同条件下,单质铍与酸的反应比单质锂与酸的反应剧烈(酸浓度相同)(2)、解释发生的原因。金属钠比金属铝更容易与氯气反应的原因是。(3)、判断性质的强弱。判断下列各组化合物的酸碱性强弱(用“>”或“<”表示)。
①
②
③
(4)、类比物质的反应。碱金属铷()与水发生反应的离子方程式为(5)、推断物质的结构。已知硫与氧处于同一主族,根据、的结构特点,书写、(二硫化碳)的电子式:、。16. 常温下为黄色气体,具有强氧化性,易溶于水但不与水反应,具有良好的除臭与脱色能力,是净化饮用水的一种十分有效的净水剂。(1)、一种制取方法是 , 该反应中没有出现的物质类别是(填字母)。a.酸 b.碱 c.盐 d.氢化物 e.氧化物 g.单质
(2)、将氯气通入溶液中可制得和一种生活中常见的盐,反应的化学方程式为 , 其中X的化学式为。(3)、和均能将电镀废水中的氧化为无毒的物质,自身被还原为。处理含相同的电镀废水时,所需的物质的量是的倍。(4)、一种有成分为、、的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到溶液。上述过程中,生成的反应属于歧化反应(氧化剂和还原剂为同一种物质的反应),每生成消耗的量为mol;产生“气泡”的化学方程式为。(5)、自来水厂用处理后的水中,要求的浓度在。下列方法可以检测水中的浓度,具体步骤如下:步骤一:准确量取的溶液10 mL,稀释配制成100 mL的溶液。
步骤二:量取处理后的水样于烧杯中,并将溶液调至中性,加入一定量的碘化钾,反应为 , 加入少许淀粉后溶液变蓝色。
步骤三:蓝色溶液中加入步骤一稀释后的溶液10 mL恰好使蓝色完全消失,且半分钟内不变色(已知:)。
①步骤一中配制溶液所需的玻璃仪器有烧杯、玻璃棒和、。
②水样中的浓度是。
17. 一氧化氮在人体中为信使分子,但会带来酸雨、臭氧层的破坏等环境问题,对的尾气处理和排放控制显得十分重要。(1)、汽车尾气是的来源,发动机中产生的反应为。恒温、恒压的容器中,下列说法说明反应达到平衡的是____(填字母)。A、氮气、一氧化氮消耗速率相同 B、、、物质的量之比为1∶1∶2 C、混合气体的密度不再变化 D、反应混合物中、、百分组成不变(2)、氨法脱氮:即与在催化剂条件下可反应生成对空气无污染的物质,该反应的化学方程式是。(3)、尿素溶液脱氮:首先是将氧化为及等,产物再与尿素反应生成、等无污染气体。尿素溶液脱氮一般控制温度为50℃~70℃,过高的温度会导致去除率下降,其原因是。(4)、乙烯脱氮:其脱氮原理的示意图如图所示,该过程中乙烯作(选填“氧化剂”“还原剂”或“催化剂”)。 (5)、已知用空气氧化溶液制取铁黄()的反应为。能起催化作用,催化机理分两步完成:
(5)、已知用空气氧化溶液制取铁黄()的反应为。能起催化作用,催化机理分两步完成:第一步的离子方程式为(棕色),
第二步的离子方程式为。
三、综合题
-
18. 磷酸亚铁为黄白色至米色粉末﹐难溶于水和醋酸,溶于无机酸,可作为营养增补剂(铁质强化剂)。合成磷酸亚铁时的主要离子反应为:(1)、合成磷酸亚铁时,在三颈烧瓶中先加人维生素C稀溶液(具有还原性)作底液,再向烧瓶中滴入与的混合溶液,再滴入溶液,水浴加热、保持左右不断搅拌(装置如图所示)。

①配制合成所需的溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是。
②用维生素C作底液而不用铁粉,其主要原因是。
③合成时需保持左右,控制pH不能太大也不能太小的原因是。
(2)、从三颈烧瓶得到产品需要过滤﹑洗涤等步骤,判断沉淀洗涤干净的操作是。(3)、合成磷酸亚铁所需的在工业上可由硫铁矿烧渣(主要成分为、、)制备,其工业流程如下(相关金属离子生成氢氧化物沉淀的pH如下表所示):
金属离子
开始沉淀的pH
沉淀完全的pH
1.1
3.2
3.0
5.0
5.8
8.8
①矿渣的主要成分是(填化学式)。
②加入溶液调pH的范围是。
③“酸化、调pH、结晶”过程中都需要进行的分离操作是。