人教版化学九年级上册第三单元 物质构成的奥秘 单元检测
试卷更新日期:2022-07-30 类型:单元试卷
一、单选题
-
1. 春天里百花竞开,阵阵清香沁人心脾,能闻到花香的原因是( )A、分子由原子构成 B、分子间有间隔 C、分子不断运动 D、分子很小2. 下列关于分子、原子的说法不正确的是( )A、原子是化学变化中的最小微粒 B、分子、原子、离子都可以直接构成物质 C、所有的原子都由质子、电子、中子构成 D、物质热胀冷缩现象的实质是微观粒子间的间隔变化3. 下列关于用微粒知识解释生活中现象的说法,不正确的是( )A、酒香不怕巷子深——微粒在不停运动 B、1滴水中含有1.67×1021个H2O分子——微粒是很小的 C、气体可以压缩——微粒大小可以改变 D、食盐溶液能导电——溶液中存在能自由移动的离子4. 如图为某原子结构模型图,其中a、b、c是构成该原子的三种不同粒子。下列说法中正确的是( )
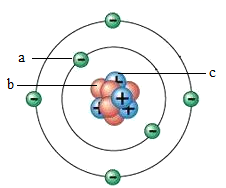 A、原子核由a和c构成 B、原子中a与c的数目一定相等 C、原子中b与c的数目一定相等 D、原子的质量主要集中在a和b上5. 如图所示是某离子的结构示意图,下列说法错误的是( )
A、原子核由a和c构成 B、原子中a与c的数目一定相等 C、原子中b与c的数目一定相等 D、原子的质量主要集中在a和b上5. 如图所示是某离子的结构示意图,下列说法错误的是( ) A、该离子的核内质子数为11 B、该离子的化学性质相对稳定 C、该离子对应的元素位于第二周期 D、该离子是阳离子,符号为Na+6. 月壤中含有丰富的氦-3。已知氦-3的质子数为2,中子数为1。氦-3的核外电子数为( )A、2 B、3 C、1 D、47. 如图为铁元素在周期表中的相关信息和铁原子的结构示意图,下列说法正确的是( )
A、该离子的核内质子数为11 B、该离子的化学性质相对稳定 C、该离子对应的元素位于第二周期 D、该离子是阳离子,符号为Na+6. 月壤中含有丰富的氦-3。已知氦-3的质子数为2,中子数为1。氦-3的核外电子数为( )A、2 B、3 C、1 D、47. 如图为铁元素在周期表中的相关信息和铁原子的结构示意图,下列说法正确的是( )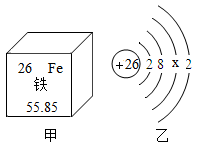 A、X的值为14 B、铁原子核内有26个中子 C、铁元素位于元素周期表的第二周期 D、铁元素的相对原子质量为55.85g8. “矽”在1871年的《化学鉴原》最早出现,它的含量在地壳中占第二位。现代化学中“矽”元素名称和元素符号是( )A、氧O B、硅Si C、铝AI D、铁Fe9. 我国北斗三号全球卫星导航系统正式开通,北斗卫星天线金属丝的主要成分有高纯度钼,下图是钼元素在元素周期表中的信息及钼原子结构示意图,下列说法正确的是( )
A、X的值为14 B、铁原子核内有26个中子 C、铁元素位于元素周期表的第二周期 D、铁元素的相对原子质量为55.85g8. “矽”在1871年的《化学鉴原》最早出现,它的含量在地壳中占第二位。现代化学中“矽”元素名称和元素符号是( )A、氧O B、硅Si C、铝AI D、铁Fe9. 我国北斗三号全球卫星导航系统正式开通,北斗卫星天线金属丝的主要成分有高纯度钼,下图是钼元素在元素周期表中的信息及钼原子结构示意图,下列说法正确的是( ) A、钼原子的中子数为42 B、钼元素的相对原子质量是95.94g C、钼原子核外电子排布图中x为18 D、钼原子在化学变化中易失去电子
A、钼原子的中子数为42 B、钼元素的相对原子质量是95.94g C、钼原子核外电子排布图中x为18 D、钼原子在化学变化中易失去电子二、填空题
-
10. 如图向V型玻璃管左右两端分别同时滴入等量的浓氨水和浓盐酸,塞紧橡皮塞。过一会后,观察到玻璃管中有白烟产生,且位置偏右,此现象说明什么?
 11. 请用分子、原子的观点解释下列问题。(1)、墙内开花墙外香。(2)、用体温计测量体温时汞柱上升。12. 工业上制取大量氧气的方法是;画出镁原子的结构示意图。13. 钙元素是人体中的常见元素,该元素在人体内99%存在于骨骼和牙齿中,其原子结构示意图为
11. 请用分子、原子的观点解释下列问题。(1)、墙内开花墙外香。(2)、用体温计测量体温时汞柱上升。12. 工业上制取大量氧气的方法是;画出镁原子的结构示意图。13. 钙元素是人体中的常见元素,该元素在人体内99%存在于骨骼和牙齿中,其原子结构示意图为 ,该元素的原子序数是 , 该元素属于(填“金属”或“非金属”)元素,该元素原子失去最外层电子所形成的离子为(用离子符号表示)。 14. 下图是元素周期表中的一格。氖的相对原子质量为;其原子结构示意图为 , 该元素在元素周期表中位于第二周期的(填“最左边”、“中间”或“最右边”)。
,该元素的原子序数是 , 该元素属于(填“金属”或“非金属”)元素,该元素原子失去最外层电子所形成的离子为(用离子符号表示)。 14. 下图是元素周期表中的一格。氖的相对原子质量为;其原子结构示意图为 , 该元素在元素周期表中位于第二周期的(填“最左边”、“中间”或“最右边”)。 15. 化学是在分子、原子层次上研究物质的科学。
15. 化学是在分子、原子层次上研究物质的科学。
分析图得出:①②③表示物质是由分子、构成的:④的名称是;在原子中,质子数==核外电子数。
三、简答题
-
16. 写出氧、镁、氯、银元素的元素符号.17. 请从A或B两题中任选一个作答,若两题均作答,按A计分。
A补齐物质与其用途的连线
B 补齐元素信息和元素类别的连线


干燥剂
医疗急救
调味品
金属元素 非金属元素 稀有气体元素
四、综合题
-
18. 从微观角度解释下列现象:(1)、金刚石和石墨的物理性质差异很大;(2)、水和过氧化氢组成元素相同但化学性质不同。19. 元素周期表是学习化学的工具,请根据图元素周期表的部分信息回答问题。
 (1)、表中不同种元素最本质的区别是____(填字母序号)。A、质子数不同 B、中子数不同 C、电子数不同 D、相对原子质量不同(2)、画出钠离子的结构示意图。(3)、相对分子质量最小的氧化物的化学式是。(4)、氦气常用来给气球充气,主要原因除了密度小,还因为它的化学性质。(5)、在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失“电子能力逐渐减弱,得电子能力逐渐增强”。则原子半径:钠镁(填“>”、“=”或“<”,下同),原子得电子能力:硫氯。20. 请你从微粒的角度解释下列问题。(1)、用体温计测量体温时,汞柱为什么上升?(2)、钠元素和氯元素之间最本质的区别是什么?(3)、金刚石和石墨物理性质有很大差异的原因是什么?
(1)、表中不同种元素最本质的区别是____(填字母序号)。A、质子数不同 B、中子数不同 C、电子数不同 D、相对原子质量不同(2)、画出钠离子的结构示意图。(3)、相对分子质量最小的氧化物的化学式是。(4)、氦气常用来给气球充气,主要原因除了密度小,还因为它的化学性质。(5)、在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失“电子能力逐渐减弱,得电子能力逐渐增强”。则原子半径:钠镁(填“>”、“=”或“<”,下同),原子得电子能力:硫氯。20. 请你从微粒的角度解释下列问题。(1)、用体温计测量体温时,汞柱为什么上升?(2)、钠元素和氯元素之间最本质的区别是什么?(3)、金刚石和石墨物理性质有很大差异的原因是什么?五、实验探究题
-
21. 用如图装置进行实验,挤出浓氨水。
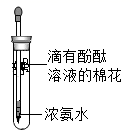 (1)、实验现象是。(2)、该实验说明分子具有的一种主要性质是。22. 某同学设计如图实验装置探究“分子的性质”。
(1)、实验现象是。(2)、该实验说明分子具有的一种主要性质是。22. 某同学设计如图实验装置探究“分子的性质”。 (1)、(知识回忆)按图Ⅰ进行实验,可观察到的现象是 , 烧杯丙的作用是 。(2)、(发现问题)虽然图Ⅰ实验现象明显,但也存在一些不足,如:氨水的用量大、实验时易闻到刺鼻的气味等。
(1)、(知识回忆)按图Ⅰ进行实验,可观察到的现象是 , 烧杯丙的作用是 。(2)、(发现问题)虽然图Ⅰ实验现象明显,但也存在一些不足,如:氨水的用量大、实验时易闻到刺鼻的气味等。(实验改进)在老师指导下,该同学改用图Ⅱ装置进行实验。在塑料瓶内用细线固定几朵小纸花(用滤纸折叠,均匀喷有酚酞溶液),用注射器沿瓶壁注入几滴浓氨水,观察到 , 该现象主要说明分子的性质是 。
(3)、(实验拓展)取两个相同的塑料瓶,用两个注射器分别同时注入相同滴数的氨水后,再将其同时浸入装有等体积的热水和冷水的烧杯中(如图Ⅲ),发现 , 说明温度对分子的运动速率产生了影响。(4)、(实验结论)图Ⅲ实验说明:温度越高,分子运动速率。(5)、(实验反思)对比图Ⅰ实验,图Ⅱ实验的优点是(写一条即可)。23. 某同学设计了以下两个实验方案验证微粒的性质,请回答有关问题. (1)、[实验方案一]如图1.
(1)、[实验方案一]如图1.观察到的实验现象是。
(2)、但另一同学认为该同学的方案不严谨,对实验进行了改进:如图2,在另一个烧杯放相同体积的酚酞溶液,放置在空气中,他的目的是。(3)、[实验方案二]如图3制作两个材质、大小、形状完全相同的无色透明塑料瓶,瓶内用细线固定有用滤纸折叠成的大小和形状相同的小纸花,小纸花上都均匀喷有酚酞溶液,分别用注射器向塑料瓶中同时注入5滴浓氨水,然后将针孔处密封,再将两个塑料瓶如图4和图5分别同时放入等体积的冷水和40℃的热水中.观察到的现象是。
(4)、[实验结论]根据以上两个实验可得出的结论是。24. 结合下图中实验装置,回答有关问题: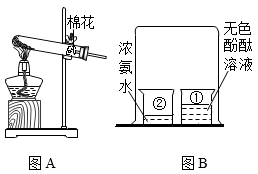
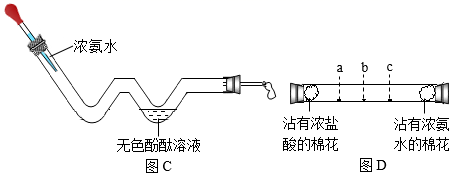 (1)、图A装置可用于在实验室制取氧气,写出反应的文字表达式:。棉花的作用是。(2)、图B和图C中都有一个相同现象即 , 说明分子在做无规则运动。试写出图C装置较图B装置的优点:(写出一条即可)。(3)、已知相同条件下,分子质量越大,运动速率越慢。图D实验中浓氨水挥发出氨气,浓盐酸挥发岀氯化氢气体,两种气体相遇会形成白烟。实验时发现长玻璃管的a处最先出现白烟,据此可知氨分子的质量(填“大于”“小于”或“等于”)氯化氢分子的质量。
(1)、图A装置可用于在实验室制取氧气,写出反应的文字表达式:。棉花的作用是。(2)、图B和图C中都有一个相同现象即 , 说明分子在做无规则运动。试写出图C装置较图B装置的优点:(写出一条即可)。(3)、已知相同条件下,分子质量越大,运动速率越慢。图D实验中浓氨水挥发出氨气,浓盐酸挥发岀氯化氢气体,两种气体相遇会形成白烟。实验时发现长玻璃管的a处最先出现白烟,据此可知氨分子的质量(填“大于”“小于”或“等于”)氯化氢分子的质量。