浙教版科学九年级上册2.5物质的转化 同步练习
试卷更新日期:2022-07-27 类型:同步测试
一、单选题
-
1. 物质王国的“小朋友”在做游戏,五位“小朋友”手拉手围成一圈(如图所示),要求相邻的“小朋友”之间必须能互相“配合”(即必须能发生化学反应),他们才能将游戏进行下去。场外还有四位替补“队员”。下列有关说法正确的是( )
 A、圈内相邻“小朋友”的溶液均为无色 B、五位“小朋友”中的任意两位均不能互相调换位置 C、若“Na2CO3”小朋友玩累了,可换上场外的“K2CO3” D、若“Ba(OH)2”小朋友玩累了,可换上场外的“KOH”2. 下列物质间的转化不能通过一步反应实现的是( )A、Fe→FeS B、AgNO3→Ag C、CaCl2→CaCO3 D、Cu→Cu(OH)23. 如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,判断下列选项正确的是( )
A、圈内相邻“小朋友”的溶液均为无色 B、五位“小朋友”中的任意两位均不能互相调换位置 C、若“Na2CO3”小朋友玩累了,可换上场外的“K2CO3” D、若“Ba(OH)2”小朋友玩累了,可换上场外的“KOH”2. 下列物质间的转化不能通过一步反应实现的是( )A、Fe→FeS B、AgNO3→Ag C、CaCl2→CaCO3 D、Cu→Cu(OH)23. 如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,判断下列选项正确的是( ) A、实现①转化,可加入氧化铜 B、实现②转化,可通入CO2 C、实现③转化,可加入稀盐酸 D、能一步实现转化的是④4. 下列物质之间的转化,经过一步反应不能实现的是( )A、CuCl2→KCl B、KNO3→K2SO4 C、Fe(OH)3→Fe2(SO4)3 D、BaCl2→BaCO35. 下列各组转化关系中的反应均为初中化学常见的反应,其中的“→”表示某种物质可以一步反应生成另一种物质。甲、乙、丙三种物质不符合对应“转化关系”的是( )
A、实现①转化,可加入氧化铜 B、实现②转化,可通入CO2 C、实现③转化,可加入稀盐酸 D、能一步实现转化的是④4. 下列物质之间的转化,经过一步反应不能实现的是( )A、CuCl2→KCl B、KNO3→K2SO4 C、Fe(OH)3→Fe2(SO4)3 D、BaCl2→BaCO35. 下列各组转化关系中的反应均为初中化学常见的反应,其中的“→”表示某种物质可以一步反应生成另一种物质。甲、乙、丙三种物质不符合对应“转化关系”的是( )选项
A
B
C
D
转化关系




物质
甲
H2O2
C
CaCO3
FeCl2
乙
O2
CO
CO2
Fe
丙
H2O
CO2
Na2CO3
Fe2O3
A、A B、B C、C D、D6. 下列物质间的转化能一步实现的是( )A、Na2CO 3 →NaOH B、CaCO3 →Ca(OH)2 C、NaNO 3 →NaCl D、FeSO 4 →CuSO47. 下列物质的转化,不能一步实现的是( )A、Cu(OH)2→CuCl2 B、Zn→H2 C、H2O→H2 D、AgCl→NaCl8. 如图所示,给出了三种物质可能存在的转化关系;根据所学的物质性质及化学变化规律, 判断下列选项正确的是( ) A、不能一步实现转化的有①② B、实现③转化,可通至氯化钠溶液 C、实现⑤转化,可加入碳酸钙粉末 D、实现⑥转化,可加入氢氧化钾溶液9. 工业炼铁的部分反应如图所示,则( )
A、不能一步实现转化的有①② B、实现③转化,可通至氯化钠溶液 C、实现⑤转化,可加入碳酸钙粉末 D、实现⑥转化,可加入氢氧化钾溶液9. 工业炼铁的部分反应如图所示,则( ) A、X可以是木炭 B、X与CO都具有氧化性 C、③反应后的尾气可直接排放 D、Y中铁元素以游离态存在10. 类推是一种重要的学习方法,下列类推结论错误的是( )
A、X可以是木炭 B、X与CO都具有氧化性 C、③反应后的尾气可直接排放 D、Y中铁元素以游离态存在10. 类推是一种重要的学习方法,下列类推结论错误的是( )①CO能与Fe2O3反应生成Fe,CO也能与CuO反应生成Cu
②活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
③有机化合物含碳元素,则含碳元素的化合物一定是有机化合物
④中和反应生成盐和水,则生成盐和水的反应一定是中和反应
⑤碱性溶液能使酚酞试液变红,则能使酚酞试液变红的溶液一定是碱性溶液
A、①②③④⑤ B、①②⑤ C、①⑤ D、②③④11. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜实验,下列说法正确是( )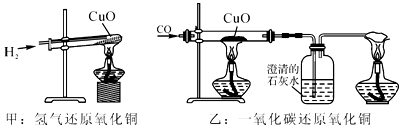 A、甲实验试管口向下倾斜可防止生成的水倒流,也有利于将试管内的空气完全排出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生置换反应12. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“—”表示相邻的两种物质能发生反应。若甲为铁,乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种,则下列判断正确的是( )
A、甲实验试管口向下倾斜可防止生成的水倒流,也有利于将试管内的空气完全排出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生置换反应12. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“—”表示相邻的两种物质能发生反应。若甲为铁,乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种,则下列判断正确的是( )
 A、乙一定是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙可能是稀H2SO413. 同学们进行了如图所示实验,成功探究出了久置氢氧化钠固体是否完全变质的情况。下列说法正确的是( )
A、乙一定是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙可能是稀H2SO413. 同学们进行了如图所示实验,成功探究出了久置氢氧化钠固体是否完全变质的情况。下列说法正确的是( ) A、甲溶液可以选择稀盐酸或BaCl2溶液(提示:BaCl2溶液显中性) B、溶液B中的溶质一定只含有NaOH和甲 C、甲溶液的作用仅为检验Na2CO3是否存在 D、若Ⅱ有明显现象、Ⅲ无明显现象,则说明样品完全变质14. 将一定质量的镁加入含AgNO3和Cu(NO3)2两种溶质的溶液中,反应结束后过滤,分别向滤液和滤渣中加入稀盐酸,均无明显现象,下列对滤渣和滤液的说明中,肯定正确的是( )A、反应结束后,溶液显无色 B、滤液中的溶质是 Mg(NO3)2、Cu(NO3)2 C、滤渣的成分是银、铜的混合物 D、所得滤液的质量小于反应前原溶液的质量15. 向AgNO3和Cu(NO3)2的混合溶液中加入一定量锌粉,充分反应后过滤,得到滤渣和蓝色滤液。关于该滤渣和滤液说法正确的是( )A、向滤渣中加入稀盐酸,可能有气泡产生 B、滤液中一定有Cu(NO3)2和Zn(NO3)2 C、滤渣中一定有Ag,可能有Cu和Zn D、滤液中一定无AgNO3 , 可能有Zn(NO3)2
A、甲溶液可以选择稀盐酸或BaCl2溶液(提示:BaCl2溶液显中性) B、溶液B中的溶质一定只含有NaOH和甲 C、甲溶液的作用仅为检验Na2CO3是否存在 D、若Ⅱ有明显现象、Ⅲ无明显现象,则说明样品完全变质14. 将一定质量的镁加入含AgNO3和Cu(NO3)2两种溶质的溶液中,反应结束后过滤,分别向滤液和滤渣中加入稀盐酸,均无明显现象,下列对滤渣和滤液的说明中,肯定正确的是( )A、反应结束后,溶液显无色 B、滤液中的溶质是 Mg(NO3)2、Cu(NO3)2 C、滤渣的成分是银、铜的混合物 D、所得滤液的质量小于反应前原溶液的质量15. 向AgNO3和Cu(NO3)2的混合溶液中加入一定量锌粉,充分反应后过滤,得到滤渣和蓝色滤液。关于该滤渣和滤液说法正确的是( )A、向滤渣中加入稀盐酸,可能有气泡产生 B、滤液中一定有Cu(NO3)2和Zn(NO3)2 C、滤渣中一定有Ag,可能有Cu和Zn D、滤液中一定无AgNO3 , 可能有Zn(NO3)2二、填空题
-
16. 为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如下实验:
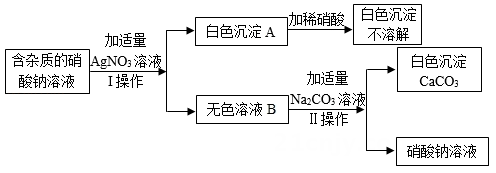
请回答下列问题:(1)、I,Ⅱ为操作。(2)、经分析,原溶液中的杂质可能由一种或几种物质组成。杂质的成分可能是:①若原溶液中的杂质由一种物质组成,则该杂质是;(填物质的名称)
②若原溶液中的杂质由两种物质组成,则该杂质的成分组成可能有种情况;
17. 有一包白色固体可能含有碳酸钙、氢氧化钙、碳酸钠中的一种或几种。小明同学为探究其成分设计并完成了如下实验:
 (1)、操作1是。(2)、步骤②的现象中出现了气泡,请判断原白色固体一定含有的成分是。18. 某固体由 Ba2+、Cu2+、Na+、Cl-、 、 中的几种离子构成,取一定质量的该固体样品,进行如下实验:
(1)、操作1是。(2)、步骤②的现象中出现了气泡,请判断原白色固体一定含有的成分是。18. 某固体由 Ba2+、Cu2+、Na+、Cl-、 、 中的几种离子构成,取一定质量的该固体样品,进行如下实验:①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。
则
(1)、该固体中一定含有的离子 ,(2)、请设计简单实验证明可能存在的离子。19. A、B、C、D 均含有同一种元素,它们的转化关系如右图(部分物质和反应条件已略去)。 (1)、若 A 是紫红色金属,D 为难溶性碱.则D 的化学式为 , C转化为 A 的化学方程式为。(2)、若 A属于氧化物,其相对分子质量为56,A与水化合得B,C是白色难溶固体,则由D转化为C的化学方程式为。20. 我们在做“物质的鉴别”实验时,曾对硫酸铜、氯化钠、硝酸钾、氢氧化钠四种白色粉末进行鉴别以下是某同学设计的鉴别方案,请你沿着该同学的思路回答相关问题。
(1)、若 A 是紫红色金属,D 为难溶性碱.则D 的化学式为 , C转化为 A 的化学方程式为。(2)、若 A属于氧化物,其相对分子质量为56,A与水化合得B,C是白色难溶固体,则由D转化为C的化学方程式为。20. 我们在做“物质的鉴别”实验时,曾对硫酸铜、氯化钠、硝酸钾、氢氧化钠四种白色粉末进行鉴别以下是某同学设计的鉴别方案,请你沿着该同学的思路回答相关问题。

①是(填化学式)②是。
21. 某同学在实验室中以碳酸钡原料(含少量SiO2 , SiO2不参与反应)制备高纯碳酸钡的流程如图:
 (1)、试剂x应选用(填字母)。
(1)、试剂x应选用(填字母)。a.稀硫酸
b.盐酸
(2)、操作1、操作2用到的玻璃仪器有 、烧杯、玻璃棒等。(3)、滤液Y中的溶质除有:KOH、K2CO3以外肯定含有的是(填化学式)22. 某科学兴趣小组将一定质量的Fe和Zn的混合粉末加入AgNO3溶液中,充分反应后过滤,得到滤渣和滤液:(1)、如果滤液呈无色,则滤渣中一定含有的金属是;(2)、如果滤液呈浅绿色,则关于该滤渣和滤液的下列说法中正确的是 。A、向滤渣中加入稀盐酸,一定有气泡产生 B、向滤液中加入稀盐酸,一定有白色沉淀产生 C、滤渣中一定含有Ag D、滤液中一定含有Fe(NO3)2 , 一定不含AgNO3 , 可能含有Zn(NO3)223. 小科同学取了适量实验室制二氧化碳发生装置中的剩余溶液。逐滴滴加纯碱溶液,绘制产生沉淀的图象如甲图所示。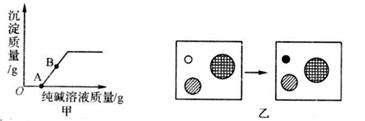 (1)、请写出B点对应溶液的溶质是(写化学式)。(2)、乙图是甲图中O点到A点的反应微观实质模型图。则“o”表示 (写化学符号)。(3)、写出OA之间发生的化学方程式。24. 有一包固体粉末可能含有NaOH、NaCl、CuCl2、Mg(OH)2、CaCO3中的一种或多种,为探究其成分,某同学取样进行了如下图所示实验:
(1)、请写出B点对应溶液的溶质是(写化学式)。(2)、乙图是甲图中O点到A点的反应微观实质模型图。则“o”表示 (写化学符号)。(3)、写出OA之间发生的化学方程式。24. 有一包固体粉末可能含有NaOH、NaCl、CuCl2、Mg(OH)2、CaCO3中的一种或多种,为探究其成分,某同学取样进行了如下图所示实验: (1)、反应生成无色气体的化学方程式为(2)、原固体粉末中不能确定是否含有的物质是。25. 碳和部分碳的化合物间转化关系如右图所示:
(1)、反应生成无色气体的化学方程式为(2)、原固体粉末中不能确定是否含有的物质是。25. 碳和部分碳的化合物间转化关系如右图所示: (1)、物质X的化学式为。(2)、在物质的分类中,CO属于 。A、酸 B、碱 C、盐 D、氧化物(3)、写出图中任意一种物质的一种用途。
(1)、物质X的化学式为。(2)、在物质的分类中,CO属于 。A、酸 B、碱 C、盐 D、氧化物(3)、写出图中任意一种物质的一种用途。三、实验探究题
-
26. 小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:
 (1)、探究加热棒内是否含有氯化钠。
(1)、探究加热棒内是否含有氯化钠。①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加(填写正确的实验操作),出现白色沉淀,证明滤液中含有Cl- , 在老师的指导下通过进一步的实验证明滤液中还含有Na+ , 从而确定含有氯化钠。
(2)、探究加热棒内是否含有铁粉,小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。小明通过如下装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2 3Fe+4H2O。当观察到这一现象时,排除了四氧化三铁存在的可能性。小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液(能将Fe2+转化为Fe3+),然后滴加硫氰化钾溶液,溶液变为血红色,证明溶液中有Fe3+ , 得出加热棒中含有铁粉这一结论。 (3)、探究加热棒内是否含有炭粉,点燃不能被磁铁吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式:、。
(3)、探究加热棒内是否含有炭粉,点燃不能被磁铁吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式:、。综合上述实验,小明验证了加热棒内的主要成分。加热棒为什么能够起到加热作用呢?小明还将进一步探究。
27. 实验室有一包没有标签的白色固体粉末,老师告知同学其可能由氯化钾、碳酸钾、氢氧化钾中的一种或几种组成。为了检测该白色粉末的成分,科学兴趣小组取一定量样品按以下流程进行实验:
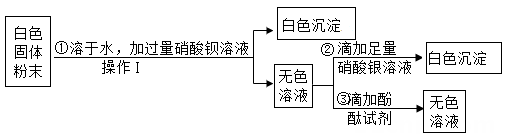 (1)、上述实验中,“操作Ⅰ”的名称是。(2)、根据实验现象,可确定组成白色固体粉末的物质有。(3)、步骤①中不能用 BaCl2 溶液代替 Ba(NO3)2 溶液,其理由是。28. 在课堂上,老师向同学们表演了“水能生火”的魔术:向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。小蔡很感兴趣,于是,他和同学们进行探究。
(1)、上述实验中,“操作Ⅰ”的名称是。(2)、根据实验现象,可确定组成白色固体粉末的物质有。(3)、步骤①中不能用 BaCl2 溶液代替 Ba(NO3)2 溶液,其理由是。28. 在课堂上,老师向同学们表演了“水能生火”的魔术:向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。小蔡很感兴趣,于是,他和同学们进行探究。[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?

[猜想]①可能有一种气体和另一种物质生成;
②反应过程中可能有热量放出。
[实验装置]如图所示
[实验探究]
实验一:探究反应后生成的气体是什么?
(1)、打开如图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃。说明生成的气体是氧气;实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:。实验二:继续探究反应后生成的另一种物质是什么?
(2)、小张猜想另一种物质是Na2CO3 , 小蔡认为不可能。小蔡的依据是:。(3)、小蔡取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色。说明反应后所得的溶液呈碱性。[表达]由实验探究的结果,写出过氧化钠和水反应的化学方程式。
29. 小兰同学设计了一个验证某NaCl溶液中是否混有Na2CO3、Na2SO4和NaOH的实验流程,如图所示。(已知BaCl2溶液呈中性) (1)、试管A中的溶液呈红色,则不一定有氢氧化钠,因为。(2)、滴加过量BaCl2溶液,充分反应后试管B中有白色沉淀产生,溶液仍显红色,则可判断原溶液中一定含有。(填化学式)(3)、再向C中加入适量X溶液,即可确定溶液成分,则X溶液可能是 (填字母)。A、稀HCl B、稀H2SO4 C、CaCl230. 盐化工是我市的一项重点产业,绿色应用是化工生产的发展方向。为了除去NaCl溶液中含有的少量MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用Na2CO3溶液、Ba(OH)2溶液、稀盐酸三种试剂,按一定的顺序进行如图所示的实验。回答下列问题。
(1)、试管A中的溶液呈红色,则不一定有氢氧化钠,因为。(2)、滴加过量BaCl2溶液,充分反应后试管B中有白色沉淀产生,溶液仍显红色,则可判断原溶液中一定含有。(填化学式)(3)、再向C中加入适量X溶液,即可确定溶液成分,则X溶液可能是 (填字母)。A、稀HCl B、稀H2SO4 C、CaCl230. 盐化工是我市的一项重点产业,绿色应用是化工生产的发展方向。为了除去NaCl溶液中含有的少量MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用Na2CO3溶液、Ba(OH)2溶液、稀盐酸三种试剂,按一定的顺序进行如图所示的实验。回答下列问题。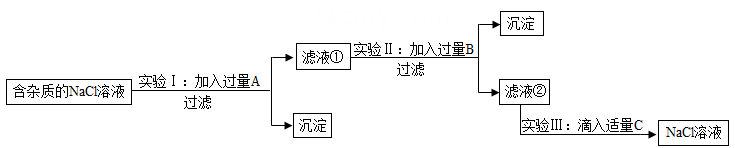 (1)、实验Ⅰ中加入试剂A除去的杂质是MgCl2和Na2SO4 , 那试剂A是溶液。(2)、实验Ⅱ中加入试剂B后过滤得到的沉淀是(填化学式)。(3)、滤液②中除NaCl外,还含有的溶质是(填化学式)。
(1)、实验Ⅰ中加入试剂A除去的杂质是MgCl2和Na2SO4 , 那试剂A是溶液。(2)、实验Ⅱ中加入试剂B后过滤得到的沉淀是(填化学式)。(3)、滤液②中除NaCl外,还含有的溶质是(填化学式)。四、解答题
-
31. 小金为测定某样品中氧化铜的质量分数,称量固体样品20.0g,用图甲所示的装置进行实验(杂质不参与反应且生成水完全被吸收),实验中共消耗0.6克氢气,测得B装置反应前后的质量增加了3.6克。
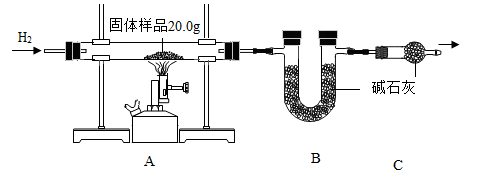 (1)、C装置的作用是;(2)、计算固体样品中氧化铜的质量分数(根据化学方程式列式计算)。32. I.同学们参观了某钢铁厂,了解到钢铁厂在选矿时测定铁矿石中含铁量的方法较多,小明结合所学知识,设计了如图1所示的实验装置测定某赤铁矿样品中Fe2O3的质量分数。他称取10.0g赤铁矿,当赤铁矿中的Fe2O3全部还原为Fe时,剩余固体在CO的保护下冷却、称量。质量为7.6g(假设赤铁矿中的杂质均不与CO反应).
(1)、C装置的作用是;(2)、计算固体样品中氧化铜的质量分数(根据化学方程式列式计算)。32. I.同学们参观了某钢铁厂,了解到钢铁厂在选矿时测定铁矿石中含铁量的方法较多,小明结合所学知识,设计了如图1所示的实验装置测定某赤铁矿样品中Fe2O3的质量分数。他称取10.0g赤铁矿,当赤铁矿中的Fe2O3全部还原为Fe时,剩余固体在CO的保护下冷却、称量。质量为7.6g(假设赤铁矿中的杂质均不与CO反应).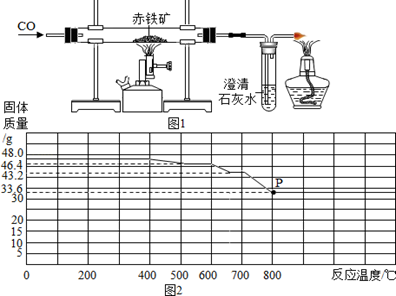 (1)、图中酒精灯的作用是。(2)、该赤铁矿中Fe2O3的质量分数是多少?(需有计算过程)。(3)、II.在钢铁厂的实验室,同学们采集了用某种热分析仪记录的CO与Fe2O3进行反应时的有关数据,并得到固体质量与反应温度的关系曲线。如图2所示。根据图象分析。
(1)、图中酒精灯的作用是。(2)、该赤铁矿中Fe2O3的质量分数是多少?(需有计算过程)。(3)、II.在钢铁厂的实验室,同学们采集了用某种热分析仪记录的CO与Fe2O3进行反应时的有关数据,并得到固体质量与反应温度的关系曲线。如图2所示。根据图象分析。写出P点时固体主要成分的化学式。
(4)、此时至少消粍CO的质量是多少?(列方程式计算)33. 赤铁矿石的主要成分是氧化铁。小明取干燥赤铁矿石样品15g,用如图所示实验来测定其中氧化铁的质量(矿石中的杂质不发生化学变化),氧化铁与氢气反应的化学方程式为:Fe2O3+3H2 2Fe+3H2O。
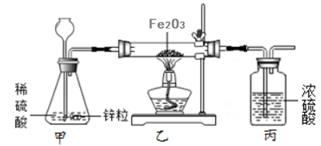 (1)、实验时,加热前要先通一会儿氢气,其目的是。(2)、完全反应后,继续通入氢气直至乙装置完全冷却。小明测得丙装置反应前后质量增加3.6g,则该赤铁矿石样品中氧化铁的质量有多少?(计算结果保留至小数点后一位)(3)、其他同学认为小明的方式会导致氧化铁质量分测量结果存在误差,比较测量值与真实值的大小关系并说明理由:。34. 钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500吨含氧化铁(Fe2O3)64%的赤铁矿石进行炼铁,高炉炼铁的原理为3CO+Fe2O3 2Fe+3CO2。计算(1)、铁矿石中氧化铁的质量为吨;(2)、这些矿石理论上能炼得铁多少吨?(写出简明的计算过程)35. 某科学兴趣小组对一份含铁的固体样品进行探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了17.6克固体样品,用图甲所示的装置进行实验,测定的数据如图乙所示。
(1)、实验时,加热前要先通一会儿氢气,其目的是。(2)、完全反应后,继续通入氢气直至乙装置完全冷却。小明测得丙装置反应前后质量增加3.6g,则该赤铁矿石样品中氧化铁的质量有多少?(计算结果保留至小数点后一位)(3)、其他同学认为小明的方式会导致氧化铁质量分测量结果存在误差,比较测量值与真实值的大小关系并说明理由:。34. 钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500吨含氧化铁(Fe2O3)64%的赤铁矿石进行炼铁,高炉炼铁的原理为3CO+Fe2O3 2Fe+3CO2。计算(1)、铁矿石中氧化铁的质量为吨;(2)、这些矿石理论上能炼得铁多少吨?(写出简明的计算过程)35. 某科学兴趣小组对一份含铁的固体样品进行探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了17.6克固体样品,用图甲所示的装置进行实验,测定的数据如图乙所示。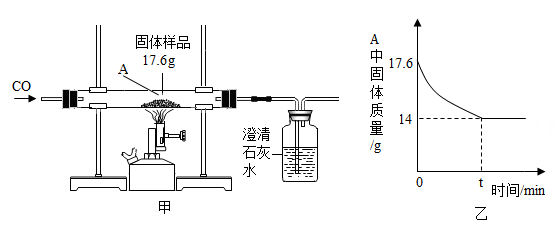 (1)、目前世界上已有50%以上的废钢铁得到回收利用,其目的是。
(1)、目前世界上已有50%以上的废钢铁得到回收利用,其目的是。A.节约金属资源 B.加大矿物开采 C.保护环境
(2)、该实验有明显的不足,应该如何改进。(3)、乙图可知,原样品中含氧元素的质量为g。(4)、某钢铁厂每天消耗5000t含氧化铁84%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?