浙教版科学九年级上册1.5酸和碱之间发生的反应 同步练习
试卷更新日期:2022-07-27 类型:同步测试
一、单选题
-
1. 胃酸可以帮助食物的消化,但是胃酸过多,就会伤及胃、十二指肠黏膜,造成胃溃疡或十二指肠溃疡等疾病。药物治疗可以口服抑酸剂,饮食治疗可以适当食用的食物是( )A、苹果pH=3.4
 B、萝卜pH=4.6
B、萝卜pH=4.6  C、土豆pH=5.4
C、土豆pH=5.4  D、板栗pH=8.8
D、板栗pH=8.8  2. 鸡蛋壳的主要成分是碳酸钙。某同学决定利用厨房里常见的物品制作一个“无壳鸡蛋”。他可将鸡蛋泡入( )A、酱油 B、黄酒 C、白醋 D、植物油3. 将25克20%的氢氧化钠溶液和25克20%的稀硫酸充分混合,混合后的溶液与下列物质不能发生反应的是( )A、氧化铜 B、二氧化碳 C、氯化钡溶液 D、硫酸铜溶液4. 向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( )
2. 鸡蛋壳的主要成分是碳酸钙。某同学决定利用厨房里常见的物品制作一个“无壳鸡蛋”。他可将鸡蛋泡入( )A、酱油 B、黄酒 C、白醋 D、植物油3. 将25克20%的氢氧化钠溶液和25克20%的稀硫酸充分混合,混合后的溶液与下列物质不能发生反应的是( )A、氧化铜 B、二氧化碳 C、氯化钡溶液 D、硫酸铜溶液4. 向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( ) A、a点所示的溶液中含有的溶质是NaOH和 NaCl B、a、b、c所示的溶液中都含有Na+、Cl- C、c点表示NaOH和稀盐酸恰好完全反应 D、b点所示的溶液能使紫色石蕊溶液变红5. 取稀盐酸与氢氧化钠反应后的溶液进行实验。下列能说明稀盐酸、氢氧化钠恰好都完全反应的是( )A、加硝酸银溶液,有白色沉淀生成 B、加氢氧化镁固体,固体全部溶解 C、加酚酞试液,溶液显红色 D、测定溶液的pH,刚好显中性6. 稀HCl和NaOH溶液混合后发生反应但无明显现象,下列操作及实验现象(或结果),不能证明反应发生的是( )
A、a点所示的溶液中含有的溶质是NaOH和 NaCl B、a、b、c所示的溶液中都含有Na+、Cl- C、c点表示NaOH和稀盐酸恰好完全反应 D、b点所示的溶液能使紫色石蕊溶液变红5. 取稀盐酸与氢氧化钠反应后的溶液进行实验。下列能说明稀盐酸、氢氧化钠恰好都完全反应的是( )A、加硝酸银溶液,有白色沉淀生成 B、加氢氧化镁固体,固体全部溶解 C、加酚酞试液,溶液显红色 D、测定溶液的pH,刚好显中性6. 稀HCl和NaOH溶液混合后发生反应但无明显现象,下列操作及实验现象(或结果),不能证明反应发生的是( ) A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于77. 稀盐酸、稀硫酸以及其他的酸溶液中都含有氢离子,所以它们具有相似的化学性质。下列一组“稀盐酸酸性的实验”中,其本质不是由氢离子参加反应的是( )
A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于77. 稀盐酸、稀硫酸以及其他的酸溶液中都含有氢离子,所以它们具有相似的化学性质。下列一组“稀盐酸酸性的实验”中,其本质不是由氢离子参加反应的是( ) A、AgNO3 B、NaOH C、Fe粉 D、CuO8. 下列离子组能在pH=10的无色溶液中大量共存的是( )A、NO3- , K+ , Na+ , H+ B、K+ , SO42- , Na+ , NO3- C、Cl- , K+ , SO42- , Cu2+ D、Ca2+ , Cl- , CO32- , Na+9. 胃溃疡严重的病人胃酸过多,可内服含有能跟盐酸起反应的物质成分的胃药,以减少胃中盐酸的含量而又不造成胃穿孔。下列物质中最适宜作为治疗胃溃疡的胃药成分的是 ( )A、BaCO3 B、Al(OH)3 C、Na2CO3 D、Ca(OH)210. 下列对部分化学知识点的归纳完全正确的一组是( )
A、AgNO3 B、NaOH C、Fe粉 D、CuO8. 下列离子组能在pH=10的无色溶液中大量共存的是( )A、NO3- , K+ , Na+ , H+ B、K+ , SO42- , Na+ , NO3- C、Cl- , K+ , SO42- , Cu2+ D、Ca2+ , Cl- , CO32- , Na+9. 胃溃疡严重的病人胃酸过多,可内服含有能跟盐酸起反应的物质成分的胃药,以减少胃中盐酸的含量而又不造成胃穿孔。下列物质中最适宜作为治疗胃溃疡的胃药成分的是 ( )A、BaCO3 B、Al(OH)3 C、Na2CO3 D、Ca(OH)210. 下列对部分化学知识点的归纳完全正确的一组是( )①碱的水溶液显碱性,但显碱性的不一定是碱的溶液; ② 用pH试纸测得食醋的pH为9.2; ③ 用洗洁精清洗油污是利用洗洁精的乳化功能; ④ 稀盐酸、稀硫酸化学性质相似是因为它们的溶液中所含的阳离子只有氢离子; ⑤ 打开浓盐酸瓶盖有白烟; ⑥ 浓硫酸不慎沾在皮肤上,要用大量水冲洗,再涂上硼酸溶液; ⑦ 生成盐和水的反应一定是中和反应
A、①③④ B、①③⑤⑥ C、①③④⑦ D、①②③④11. 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化,其图像如图所示,下列说法正确的是( ) A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4 C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 D、由a点到b点的pH变化过程证明酸和碱发生了中和反应12. 向氢氧化钡溶液中逐滴加入稀硫酸,某个量y随稀硫酸的加入的变化情况如图所示,则y表示( )
A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4 C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 D、由a点到b点的pH变化过程证明酸和碱发生了中和反应12. 向氢氧化钡溶液中逐滴加入稀硫酸,某个量y随稀硫酸的加入的变化情况如图所示,则y表示( ) A、溶质的质量 B、氢氧化钡的质量 C、溶液的pH D、沉淀的质量13. 下列反应属于酸碱中和反应的是( )A、Cu(OH)2+2HNO3=Cu(NO3)2+2H2O B、CO2+H2O = H2CO3 C、2KMnO4 K2MnO4+MnO2+O2↑ D、HCl+AgNO3 = AgCl↓+HNO314. 右图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论不正确的是( )
A、溶质的质量 B、氢氧化钡的质量 C、溶液的pH D、沉淀的质量13. 下列反应属于酸碱中和反应的是( )A、Cu(OH)2+2HNO3=Cu(NO3)2+2H2O B、CO2+H2O = H2CO3 C、2KMnO4 K2MnO4+MnO2+O2↑ D、HCl+AgNO3 = AgCl↓+HNO314. 右图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论不正确的是( ) A、反应结束时溶液的pH=7 B、反应前后元素的种类没有变化 C、氢氧化钠溶液中存在的粒子只有Na+和OH- D、该反应的实质是H+和OH-结合生成H2O分子15. 下列实际应用中,利用酸碱中和反应原理的是( )
A、反应结束时溶液的pH=7 B、反应前后元素的种类没有变化 C、氢氧化钠溶液中存在的粒子只有Na+和OH- D、该反应的实质是H+和OH-结合生成H2O分子15. 下列实际应用中,利用酸碱中和反应原理的是( )①用氢氧化钠溶液洗涤石油产品中的残余硫酸;②用碳酸氢钠治疗胃酸过多;
③用熟石灰改良酸性土壤;④用稀氨水(弱碱)涂抹在蚊子叮咬处(分泌出蚁酸)止痒
A、①② B、②③④ C、②③ D、①③④16. 在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全反应的是( )A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、测得反应后溶液中Na+与Cl-的个数比为1:1 D、滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀二、实验探究题
-
17. 实验小组同学向盛有2mL稀硫酸的试管中加入2mL氢氧化钠溶液,未观察到明显现象.
【提出问题】两者是否发生了化学反应?
【实验探究】将盛有上述实验混合液的试管标为①,如图甲.

小华:测得实验所用稀硫酸的pH<7,试管①中溶液pH>7.于是得出结论: .
小敏:取两支试管,编号为②和③,分别加入稀硫酸和试管①中溶液各2mL,逐滴滴加Na2CO3溶液至过量,实验过程与现象如图乙,由此他得出了与小华一样的实验结论.
【反思评价】小军认为小敏在实验设计中存在不够严密的地方,请帮他指出:
【交流讨论】试管③中的溶液中有哪些溶质?同学们分析了两位同学的实验过程,一致认为没有H2SO4 , 其理由是 . 在此基础上,同学们提出了二种推理:
推理1:含有Na2SO4、Na2CO3和NaOH
推理2:含有Na2SO4、Na2CO3
正确的是推理(选填“1”或“2”)
18. 为探究“稀盐酸和氢氧化钠溶液反应过程中,溶液的pH及温度随时间变化关系”,小科按图甲连接好实验装置,往盛有一种溶液的烧杯中滴入另一种初温相同的溶液,同时用玻璃棒搅拌,数字采集器和计算机实时显示数据和曲线(如图乙):横坐标表示时间,左边纵坐标表示pH,右边纵坐标表示溶液的温度。结合反应过程并分析曲线,回答下列问题: (1)、胶头滴管中的试剂是 , 150秒时烧杯中溶液含有的溶质是。(2)、烧杯中溶液的温度升高的原因是。19. 某小组想证明稀硫酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计,实施和评价,并得出有关结论。
(1)、胶头滴管中的试剂是 , 150秒时烧杯中溶液含有的溶质是。(2)、烧杯中溶液的温度升高的原因是。19. 某小组想证明稀硫酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计,实施和评价,并得出有关结论。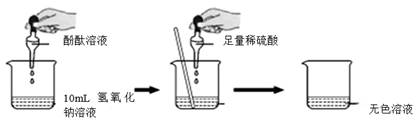 (1)、探究稀硫酸与氢氧化钠溶液的反应根据上图所示实验,当看到烧杯中溶液颜色发生了怎样的变化?答:。由此可确定稀硫酸与氢氧化钠溶液发生了化学变化。(2)、探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
(1)、探究稀硫酸与氢氧化钠溶液的反应根据上图所示实验,当看到烧杯中溶液颜色发生了怎样的变化?答:。由此可确定稀硫酸与氢氧化钠溶液发生了化学变化。(2)、探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:实验方案
实验步骤
实验现象
实验结论
方案一
取样,滴入适量的氯化钡溶液
出现白色沉淀
稀硫酸过量
方案二
取样,滴入几滴紫色石蕊试液
溶液变红
稀硫酸过量
上述设计的实验方案中,正确的是(填“方案一”或“方案二”)。请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是 , 实验现象及对应结论是。
20. 某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。Ⅰ、写出该中和反应的化学方程式:。
Ⅱ、探究烧杯内溶液中溶质的成分。
(提出问题)该烧杯内溶液中的溶质是什么?
(猜 想)猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:。
(查阅资料)氯化钙溶液呈中性。
(进行实验)
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:。结论:猜想一不正确。
实验步骤:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象:。结论:猜想二不正确,猜想三正确。
根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?(填序号)
A.pH试纸 B.铜 C.紫色石蕊溶液 D.硝酸银溶液
21. 在研究NaOH溶液与稀盐酸反应时,某兴趣小组的同学设计并完成了如下实验:实验①:在烧杯中注入适量NaOH溶液,测得其pH=13;然后将一定量的稀盐酸注入烧杯中与NaOH溶液充分混合,测得混合后溶液的pH=8。
实验②:在烧杯中注入适量NaOH溶液,并滴加2滴酚酞试液,溶液呈红色;然后将一定量的稀盐酸注入烧杯中,发现红色褪去。
(1)、根据实验①的现象,能否证明NaOH溶液与稀盐酸发生了化学反应,请简要说明理由。(2)、有同学猜想,实验②反应后的溶液中可能存在稀盐酸过量;下列试剂,能检验该 同学猜想的是 (选填字母)。A、氢氧化铜 B、铜粉 C、紫色石蕊试液 D、AgNO3 溶液(3)、写出NaOH 溶液与稀盐酸反应的实质:。三、填空题
-
22. 观察和实验是学习科学的两种基本方法。请判断下列操作或实验中能观察到的现象:(1)、打开盛有浓盐酸试剂瓶的瓶盖,瓶口会看到 , 这是挥发出来的氯化氢气体与空气中的水蒸气结合形成的盐酸小液滴。(2)、向一只盛有稀盐酸的试管中滴加几滴紫色石蕊试液,发现试液变成 , 说明稀盐酸呈酸性。(3)、将鸡蛋放入盛有稀盐酸的烧杯中,发现蛋壳(主要成分是碳酸钙)表面有。23. 如图所示为将稀硫酸逐滴滴入加有酚酞试液的氢氧化钠溶液直至过量的实验操作和反应的微观示意图,回答问题:
 (1)、图中甲表示的微粒是(填写符号);(2)、验证反应后溶液中稀硫酸有剩余,可行的操作是 。A、取样,滴加少量紫色石蕊试液 B、取样,滴加少量CuSO4溶液 C、取样,加入少量CaCO3粉末 D、取样,滴加少量Ba(NO3)2溶液24. 中和反应是一类重要的化学反应。某同学利用图甲装置研究稀盐酸与氢氧化钠溶液反应的过程,并用 pH 和温度传感器测量反应过程中相关物理量的变化情况,得到图乙和图丙。
(1)、图中甲表示的微粒是(填写符号);(2)、验证反应后溶液中稀硫酸有剩余,可行的操作是 。A、取样,滴加少量紫色石蕊试液 B、取样,滴加少量CuSO4溶液 C、取样,加入少量CaCO3粉末 D、取样,滴加少量Ba(NO3)2溶液24. 中和反应是一类重要的化学反应。某同学利用图甲装置研究稀盐酸与氢氧化钠溶液反应的过程,并用 pH 和温度传感器测量反应过程中相关物理量的变化情况,得到图乙和图丙。 (1)、仪器 A 中溶液的溶质是 (填化学式)。(2)、图乙中 d 点所示溶液中的溶质是(3)、下列说法正确的是A、图乙中c→d 所示溶液中NaCl 的质量不断增加 B、图丙中 e→f 变化可说明该反应是放热反应 C、取图乙中d 点所示溶液加热蒸干所得固体为纯净物.25. 有10mL稀盐酸(其中滴有少量紫色石蕊试剂)的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下。请分析并回答下列问题:
(1)、仪器 A 中溶液的溶质是 (填化学式)。(2)、图乙中 d 点所示溶液中的溶质是(3)、下列说法正确的是A、图乙中c→d 所示溶液中NaCl 的质量不断增加 B、图丙中 e→f 变化可说明该反应是放热反应 C、取图乙中d 点所示溶液加热蒸干所得固体为纯净物.25. 有10mL稀盐酸(其中滴有少量紫色石蕊试剂)的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下。请分析并回答下列问题:加入NaOH溶液的体积/mL
0
2
4
6
8
10
12
14
烧杯中溶液的pH
1.1
1.2
1.4
1.6
2.0
7.0
11.0
12.2
(1)、当加入氢氧化钠溶液的体积为 mL时,稀盐酸和氢氧化钠溶液恰好完全反应,该反应的化学方程式是;(2)、当加入氢氧化钠溶液的体积为13mL时,溶液中的溶质有哪些?;(用化学式表示)
26. 酸、碱、盐等是我们学过的重要物质,请根据相关知识回答下列问题:(1)、稀盐酸能除铁锈(铁锈的主要成分是Fe2O3),写出稀盐酸除锈反应的化学方程式。(2)、服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多症,该反应的化学方程式为。27. 酸碱盐是我们学过的重要物质,请根据相关知识回答下列问题:(1)、稀盐酸能除铁锈(铁锈的主要成分是氧化铁),写出稀盐酸除铁锈的方程式:。(2)、服用含氢氧化铝Al(OH)3的药物可以治疗胃酸过多症,该反应的化学方程式为:。28. 某化工厂在三废处理中采取以下措施,请写出可使用的化学药品:(1)、可用(写化学式)溶液吸收含二氧化硫的尾气;(2)、可用 (写俗名)中和酸性废水、改良酸性土壤。29. 酸奶作为一种营养丰富、老幼皆宜的饮料,已成为大众化的食品。(1)、酸奶是由新鲜全脂牛奶经乳酸菌发酵制得,此过程属于(“物理”或“化学”)变化。(2)、酸奶显酸性,则酸奶的pH(填“>”、“<”或“=”)7;(3)、过量饮用酸奶易导致胃酸过多,可服用含氢氧化铝的药物治疗,发生反应的化学方程式是。30. 人类的日常生活离不开酸、碱、盐三类物质,请回答下列问题:(1)、山药中含有皂角素,呈碱性,皮肤沾上会奇痒难忍。你认为可涂厨房中的 来止痒;A、苏打(Na2CO3) B、食醋(CH3COOH) C、蔗糖(C12H22O11)(2)、胃酸主要成分是盐酸,具有杀菌、帮助消化的作用,如果胃酸过多反而会伤及胃、十二指肠等,可用含有氢氧化铝的药物“胃舒平”治疗胃酸过多症。某胃酸过多的病人按医生处方服用合适剂量的“胃舒平”后缓解了症状。下列图像大致符合病人服用合适剂量的“胃舒平”后胃液 pH 变化的是 。A、 B、
B、 C、
C、 31. 用氢氧化钠中和一定量的盐酸时,溶液的pH与加入的氢氧化钠质量的关系如图所示,当加入氢氧化钠mg时,溶液中的溶质为 . 若改用ng氢氧化钠与相同量盐酸反应,所得溶液的pH7(填“>”、“<”或“=”).
31. 用氢氧化钠中和一定量的盐酸时,溶液的pH与加入的氢氧化钠质量的关系如图所示,当加入氢氧化钠mg时,溶液中的溶质为 . 若改用ng氢氧化钠与相同量盐酸反应,所得溶液的pH7(填“>”、“<”或“=”).
四、解答题
-
32. 实验室有一瓶新配的烧碱溶液,小明同学设计实验测定了其溶质质量分数。请根据如图所示的实验过程和提供的数据进行分析和计算。(注:滴入酚酞的质量忽略不计)
 (1)、将稀盐酸逐滴滴入锥形瓶的过程中,边滴加稀盐酸边振荡锥形瓶,当观察到时,恰好完全反应,停止滴液。(2)、通过计算确定该瓶烧碱溶液的溶质质量分数。(写出计算步骤)(3)、问题讨论:若小明在滴加盐酸的过程中没有同时振荡锥形瓶,实验结果会(填“偏大”、“偏小”或“不变”)。33. 小敏同学在做完Ca(OH)2与稀盐酸的中和实验后,对废液继续如下探究(见下图)。取甲反应后的溶液143.3g,滴加质量分数26.5%的Na2CO3溶液(如图乙),溶液pH的变化如图所示。请试着分段简述图中pH值如此变化的原因,并求出C点对应溶液的溶质质量分数。(精确到0.01%)
(1)、将稀盐酸逐滴滴入锥形瓶的过程中,边滴加稀盐酸边振荡锥形瓶,当观察到时,恰好完全反应,停止滴液。(2)、通过计算确定该瓶烧碱溶液的溶质质量分数。(写出计算步骤)(3)、问题讨论:若小明在滴加盐酸的过程中没有同时振荡锥形瓶,实验结果会(填“偏大”、“偏小”或“不变”)。33. 小敏同学在做完Ca(OH)2与稀盐酸的中和实验后,对废液继续如下探究(见下图)。取甲反应后的溶液143.3g,滴加质量分数26.5%的Na2CO3溶液(如图乙),溶液pH的变化如图所示。请试着分段简述图中pH值如此变化的原因,并求出C点对应溶液的溶质质量分数。(精确到0.01%) 34. 实验室有一瓶标签被腐蚀的盐酸,小科为了测定溶液中溶质的质量分数,在烧杯中配制了8 g 10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:(1)、配制了8 g 10%的NaOH溶液,需要水的质量为。(2)、计算该盐酸的溶质质量分数。(写出计算过程)(3)、当滴入4 g盐酸时,烧杯内溶液中钠元素的质量为。
34. 实验室有一瓶标签被腐蚀的盐酸,小科为了测定溶液中溶质的质量分数,在烧杯中配制了8 g 10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:(1)、配制了8 g 10%的NaOH溶液,需要水的质量为。(2)、计算该盐酸的溶质质量分数。(写出计算过程)(3)、当滴入4 g盐酸时,烧杯内溶液中钠元素的质量为。 35. 如图表示质量分数为8%的氢氧化钠溶液与20g某浓度的稀盐酸发生反应后溶液温度的变化情况。
35. 如图表示质量分数为8%的氢氧化钠溶液与20g某浓度的稀盐酸发生反应后溶液温度的变化情况。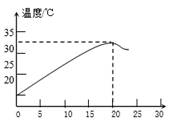 (1)、根据曲线判断,当加入氢氧化钠溶液的质量为时,恰好完全反应。(2)、当加入15g氢氧化钠溶液时,所得溶液中的阳离子为(写出离子符号)。(3)、氢氧化钠具有很强的吸水性,若在配制溶液时,称取的氢氧化钠已部分吸水,则所求得的盐酸的溶质质量分数将(选填“偏大”“偏小”或“无影响”)(4)、计算该稀盐酸的溶质质量分数。(请写出计算过程)36. 学校附近某厂排放的污水中主要的污染物为氢氧化钠。科学兴趣活动小组为了测定污水中氢氧化钠的含量,同学们首先将25%的浓盐酸稀释成5%的稀盐酸,得到稀盐酸质量100克。然后取40克污水于烧杯中,逐滴加入这种稀盐酸至73克时两者恰好完全反应(污水中的其他成分不与稀盐酸反应)。试写出计算过程:(1)、配制稀盐酸时,需溶质质量分数为25%的盐酸多少克?(2)、污水中所含氢氧化钠的质量分数是多少?
(1)、根据曲线判断,当加入氢氧化钠溶液的质量为时,恰好完全反应。(2)、当加入15g氢氧化钠溶液时,所得溶液中的阳离子为(写出离子符号)。(3)、氢氧化钠具有很强的吸水性,若在配制溶液时,称取的氢氧化钠已部分吸水,则所求得的盐酸的溶质质量分数将(选填“偏大”“偏小”或“无影响”)(4)、计算该稀盐酸的溶质质量分数。(请写出计算过程)36. 学校附近某厂排放的污水中主要的污染物为氢氧化钠。科学兴趣活动小组为了测定污水中氢氧化钠的含量,同学们首先将25%的浓盐酸稀释成5%的稀盐酸,得到稀盐酸质量100克。然后取40克污水于烧杯中,逐滴加入这种稀盐酸至73克时两者恰好完全反应(污水中的其他成分不与稀盐酸反应)。试写出计算过程:(1)、配制稀盐酸时,需溶质质量分数为25%的盐酸多少克?(2)、污水中所含氢氧化钠的质量分数是多少?