天津市南开区2022年中考二模化学试题
试卷更新日期:2022-07-22 类型:中考模拟
一、单选题
-
1. 下列历史典故中发生了化学变化的是( )A、火烧赤壁 B、司马光砸缸 C、刻舟求剑 D、铁杵磨成针2. 下列气体与空气混合后遇明火,可能发生爆炸的是( )
A、甲烷 B、氮气 C、氧气 D、二氧化碳3. 人体内含量最高的金属元素是( )A、铁 B、锌 C、钾 D、钙4. 将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是( )A、高锰酸钾 B、汽油 C、面粉 D、白糖5. 盛有下列物质的容器敞口放置在空气中一段时间后,容器内物质质量减少的是( )A、铁丝 B、浓盐酸 C、氢氧化钠 D、氧化钙6. 2022年北京冬奥会,碲化镉发电玻璃成为绿色和科技办奥交汇的创新点。如图为碲在元素周期表中的部分信息, 下列说法错误的是( ) A、碲的原子序数为52 B、碲原子的质子数为52 C、碲原子的中子数为52 D、碲的相对原子质量为127.67. 紫色卷心菜遇到碱性物质会变成黄绿色.下列能使紫色卷心菜呈黄绿色的物质是( )
下列说法错误的是( ) A、碲的原子序数为52 B、碲原子的质子数为52 C、碲原子的中子数为52 D、碲的相对原子质量为127.67. 紫色卷心菜遇到碱性物质会变成黄绿色.下列能使紫色卷心菜呈黄绿色的物质是( )物质
柠檬汁
肥皂水
食盐水
雪碧
pH
1.5
8.8
7.0
4.5
A、柠檬汁 B、雪碧 C、食盐水 D、肥皂水8. 用下列装置进行实验,不能达到实验目的的是( )A、 装置可用于干燥氧气
B、
装置可用于干燥氧气
B、 可用于收集氧气和氢气
C、
可用于收集氧气和氢气
C、 可用于除去氢气中混有的少量二氧化碳
D、
可用于除去氢气中混有的少量二氧化碳
D、 可用于收集氧气和二氧化碳
9. 下列涉及学科观点的有关说法错误的是( )A、转化观:一氧化碳和二氧化碳在一定条件下可以互相转化 B、能量观:氢氧化钠、硝酸铵溶于水都有温度变化 C、微粒观:分子、原子和离子都是构成物质的粒子 D、守恒观:3g碳在12g氧气中充分燃烧,生成15g二氧化碳10. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法正确的是( )
可用于收集氧气和二氧化碳
9. 下列涉及学科观点的有关说法错误的是( )A、转化观:一氧化碳和二氧化碳在一定条件下可以互相转化 B、能量观:氢氧化钠、硝酸铵溶于水都有温度变化 C、微粒观:分子、原子和离子都是构成物质的粒子 D、守恒观:3g碳在12g氧气中充分燃烧,生成15g二氧化碳10. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法正确的是( )
 A、四种物质中有三种为氧化物 B、参加反应的乙的质量等于生成的丙和丁中氧元素的质量之和 C、生成物丙由1个碳原子和2个氧原子构成 D、参加反应的甲和生成的丁分子个数比为1:111. 下图为化合价、物质类别二维图。a~e代表的是氧气、二氧化硫、硫酸、二氧化碳、硝酸、碳酸钾中的物质,下列说法错误的是( )
A、四种物质中有三种为氧化物 B、参加反应的乙的质量等于生成的丙和丁中氧元素的质量之和 C、生成物丙由1个碳原子和2个氧原子构成 D、参加反应的甲和生成的丁分子个数比为1:111. 下图为化合价、物质类别二维图。a~e代表的是氧气、二氧化硫、硫酸、二氧化碳、硝酸、碳酸钾中的物质,下列说法错误的是( ) A、图中X代表的物质类别是单质 B、e点的物质能与硝酸钙溶液反应,且产物之一可做复合肥料 C、b点的物质一定属于大气污染物 D、d点的物质一定是硫酸12. 下列说法正确的是( )A、检验碳酸钠溶液中是否含有硫酸钠,可加入过量的稀硫酸后,再滴加硝酸钡溶液 B、鉴别铁、氧化铜、碳三种黑色固体粉末,可分别滴加稀硫酸 C、除去氯化钠中的硫酸钠和氯化钙,可取样,加水充分溶解,依次加入过量的碳酸钠溶液和氯化钡溶液,过滤后,向滤液中加入过量稀盐酸,蒸发 D、若不用其他试剂,鉴别①氯化钠溶液、②氢氧化钠溶液、③氯化铜溶液,鉴别出的先后顺序可能是③①②13. 甲、乙、丙、丁是初中化学常见的物质,丙是一种能产生温室效应的气体,他们之间的转化关系如图所示(反应条件、部分反应物和生成物已略去,“—”表示相连的两种物质之间可以发生反应,“→”表示物质的转化关系)。下列说法正确的是( )
A、图中X代表的物质类别是单质 B、e点的物质能与硝酸钙溶液反应,且产物之一可做复合肥料 C、b点的物质一定属于大气污染物 D、d点的物质一定是硫酸12. 下列说法正确的是( )A、检验碳酸钠溶液中是否含有硫酸钠,可加入过量的稀硫酸后,再滴加硝酸钡溶液 B、鉴别铁、氧化铜、碳三种黑色固体粉末,可分别滴加稀硫酸 C、除去氯化钠中的硫酸钠和氯化钙,可取样,加水充分溶解,依次加入过量的碳酸钠溶液和氯化钡溶液,过滤后,向滤液中加入过量稀盐酸,蒸发 D、若不用其他试剂,鉴别①氯化钠溶液、②氢氧化钠溶液、③氯化铜溶液,鉴别出的先后顺序可能是③①②13. 甲、乙、丙、丁是初中化学常见的物质,丙是一种能产生温室效应的气体,他们之间的转化关系如图所示(反应条件、部分反应物和生成物已略去,“—”表示相连的两种物质之间可以发生反应,“→”表示物质的转化关系)。下列说法正确的是( ) A、若甲、乙均为黑色固体,则甲一定为碳,乙一定为氧化铜 B、若甲含有氢氧根离子,则乙可能是碳酸钙 C、若甲、乙依次为碱和酸,则丁可能是碳酸盐 D、丁转化为丙只能通过复分解反应实现
A、若甲、乙均为黑色固体,则甲一定为碳,乙一定为氧化铜 B、若甲含有氢氧根离子,则乙可能是碳酸钙 C、若甲、乙依次为碱和酸,则丁可能是碳酸盐 D、丁转化为丙只能通过复分解反应实现二、多选题
-
14. 下列说法中正确的是( )A、氢氧化钙溶液、乙醇和硫酸都能导电 B、棉花、羊毛都属于天然有机高分子材料,可用点燃闻气味的方法鉴别 C、催化剂在化学反应前后质量和化学性质都不会改变 D、测定稀硫酸的pH时,用玻璃棒蘸取稀硫酸滴在用水润湿的pH试纸上15. 下列说法正确的是( )A、若锌和镁混合物的质量为4.8g与100g稀硫酸恰好完全反应,则该稀硫酸的溶质质量分数可能为19.6% B、碳酸镁和碳酸钙的混合物加热完全分解后的固体中,镁和钙两种元素的质量相等,则碳酸镁和碳酸钙的质量比是15:21 C、某物质在空气中完全燃烧,生成二氧化碳和水的质量比为11:9,则该物质可能是甲烷 D、向10%的氯化钠溶液中加入10g氯化钠固体,再加入20g水,氯化钠溶液的溶质质量分数为15%,则原10%的氯化钠溶液质量为110g
三、填空题
-
16. 化学与我们的生活密切相关。现有①石墨 ②硫酸铜 ③氮气 ④干冰 ⑤盐酸 ⑥活性炭,从中选择适当的物质按下列要求填空(填序号):(1)、可用于配制波尔多液的是;(2)、可作干电池电极的是;(3)、可用于人工降雨的是;(4)、可用于冰箱除味剂的是;(5)、可用于除铁锈的是;(6)、可充入食品包装袋中防腐的是。17. “见著知微,见微知著”是化学思维方法。(1)、从宏观知微观:
①从微观上解释混合物和纯净物。对于由分子构成的物质,混合物是由(填“同种分子”或“不同种分子”)构成的。
②气体X在氧气中燃烧生成氮气和水,X分子中一定含有的原子是(填符号)。
(2)、从微观知宏观:
①A属于元素的原子(填“金属”、“非金属”或“稀有气体”)。
②A~F中达到相对稳定结构的是(填序号,下同);A~E属于同一种元素的是。
③F带1个单位正电荷,则X=。
18. 化学源于生活,生活中蕴含着许多化学知识。(1)、歌曲《在希望的田野上》曾一度唱红大江南北。歌词中:“牛羊在牧人的笛声中成长,西村纺纱,东滩撒网……”。撒网捕鱼,相当于化学实验基本操作中的 , 鱼为人体补充的营养素主要是。(2)、电解水的实验证明水是由组成的;正、负极产生气体的体积比约为。(3)、一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气,该反应的化学方程式为。19. 写出下列反应的化学方程式。(1)、碳在氧气中充分燃烧。(2)、氧化铜与氢气在加热条件下反应。(3)、氢氧化钠溶液与稀盐酸混合。20. 金属在生产、生活和社会发展中应用广泛。(1)、下列金属制品中,利用金属导热性的是____(填字母)。A、金属硬币 B、铝制导线 C、铜制火锅(2)、铝合金被广泛用于航天工业。一般情况下,铝合金的强度和硬度比纯铝(填“高”或“低”)。(3)、在古代,常常用“湿法炼铜”或“火法炼铜”。“火法炼铜”的原理是:Cu2S与氧气在高温条件下反应生成一种单质和一种会导致酸雨的气体,该反应的化学方程式为。(4)、日常生活:寒冷的冬天,“暖宝宝”因其能持久稳定发热受到人们的欢迎。“暖宝宝”中的发热原料是铁粉等物质。打开“暖宝宝”密封包装,原料与空气接触,“暖宝宝”就开始发热。“暖宝宝”发热的过程实际上是铁与发生化学反应的过程。(5)、将19.5g锌加入到含34g硝酸银和37.6g硝酸铜的混合溶液中,充分反应后过滤,滤渣中含有的物质为 , 所得溶液质量原混合溶液质量(填“>”、“<”或“=”)。四、综合题
-
21. 如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
 (1)、t2℃时若将等质量的A、B、C三种物质加入100g水中,只有一种物质形成了饱和溶液,则该物质是。(2)、要使A、B、C的不饱和溶液变成饱和溶液,下列措施一定能达到目的的是(填序号)。
(1)、t2℃时若将等质量的A、B、C三种物质加入100g水中,只有一种物质形成了饱和溶液,则该物质是。(2)、要使A、B、C的不饱和溶液变成饱和溶液,下列措施一定能达到目的的是(填序号)。①升高温度 ②加溶质 ③恒温蒸发溶剂 ④加溶剂
(3)、将t1℃三种物质的饱和溶液升温至t2℃,所得溶液溶质的质量分数由大到小的排列顺序是(填字母)。(4)、下列说法正确的是(填序号)。①t1℃时,A和C的饱和溶液溶质的质量分数都为30%
②t2℃时,A溶液比B溶液的溶质质量分数大
③t2℃时,等质量的A、B、C三种物质的饱和溶液中,A物质的溶液中溶剂的量最少
④t2℃时,30gA物质加入到50g水中不断搅拌形成溶液,该溶液的溶质质量分数是37.5%
⑤分别将A、B两物质的饱和溶液由t2℃降至t1℃时,析出晶体质量较多的是A
(5)、要配制36.8g溶质质量分数为9.8%的稀硫酸,需要溶质质量分数为98%的浓硫酸(密度为1.84g/cm3) mL;配制过程中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和。22. ①~⑥为初中化学常见物质的相互转化关系(反应条件已略去)。其中只有D、E、M为单质,且D为最轻的气体。G含有两种元素,H和L的组成元素相同。①A+B→C
②A→D+E
③F→A+E
④G+K→H+A
⑤G+M→L+D
⑥Q+K→M+B
(1)、写出物质的化学式:D、G。(2)、写出反应的化学方程式:③;⑥。23. 酸、碱、盐在生产和生活中有广泛的应用。(1)、某同学利用数字化传感设备,探究硫酸和烧碱溶液反应过程中温度和pH的变化,测定结果如图所示。
通过图像可知,该实验是将(填“硫酸”或“烧碱溶液”)滴入另一溶液中;该反应属于反应(填“吸热”或“放热”);当滴加液体的体积为10mL时,溶液中的溶质为。
(2)、现有一包固体粉末,可能由碳酸钙、氧化钙、碳酸钠中的一种或几种组成。为确定其组成,称量20g固体粉末,进行了如下图所示的实验:
①根据上述实验可以确定白色沉淀是;
②为进一步确定固体粉末的成分,将白色沉淀烘干称量其质量是10g,将X溶液蒸干称量其质量是11.7g,最终可知固体粉末是由(填化学式)组成的。
24. 请结合下列实验装置,回答有关问题。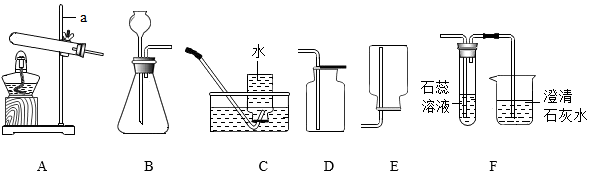 (1)、写出图中仪器a的名称:。(2)、实验室用加热氯酸钾和二氧化锰的混合物制取并收集氧气,选用的装置为(填字母),该反应的化学方程式为。(3)、实验室用石灰石和稀盐酸反应制取并收集二氧化碳,选用的装置为(填字母)。(4)、F用于验证二氧化碳的化学性质,F装置中可观察到试管中的现象;写出烧杯中发生反应的化学方程式。
(1)、写出图中仪器a的名称:。(2)、实验室用加热氯酸钾和二氧化锰的混合物制取并收集氧气,选用的装置为(填字母),该反应的化学方程式为。(3)、实验室用石灰石和稀盐酸反应制取并收集二氧化碳,选用的装置为(填字母)。(4)、F用于验证二氧化碳的化学性质,F装置中可观察到试管中的现象;写出烧杯中发生反应的化学方程式。五、计算题
-
25. “赠人玫瑰,手留余香”,玫瑰花中含有的香茅醇(化学式为C10H20O)成分具有芬芳的气味。请回答:(1)、一个香茅醇分子中含有的原子个数是(填数字)。(2)、香茅醇分子中碳、氢、氧三种元素的质量比为。(3)、15.6g香茅醇中含有的氧元素质量为g。26. 我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了杰出贡献。在实际生产的纯碱样品中会混有少量的氯化钠。现有纯碱样品,为测定该样品中碳酸钠的质量分数,称取一定质量该样品,放入20g水中使其完全溶解,再加入含氯元素3.55g的稀盐酸26.2g,恰好完全反应,气体全部逸出,将所得溶液蒸干后得到固体6.55g。计算:(1)、样品中氯化钠的质量分数(结果精确到0.1%)。(2)、反应后所得溶液中溶质的质量分数。