天津市滨海新区2022年中考二模化学试题
试卷更新日期:2022-07-22 类型:中考模拟
一、单选题
-
1. 华夏造物历史悠久,《天工开物》中记载的下列造物过程涉及化学变化的是( )A、炼生铁 B、晒海盐 C、钉木舟 D、织衣布2. 垃圾分类,从我做起。下列可回收垃圾属于金属材料的是( )A、旧报纸 B、塑料瓶 C、玻璃瓶 D、铝制易拉罐3. 滨海新区坚持生态优先、绿色发展。下列举措错误的是( )A、天更蓝——加强大气治理 B、水更清——防治水体污染 C、土更净——填埋废弃电池 D、景更美——提高绿化覆盖4. 关于元素的分布,下列说法正确的是( )A、空气中含量最多的元素是碳 B、地壳中含量最多的元素是氧 C、人体中含量最多的元素是钙 D、海洋中含量最多的元素是氯5. “火碱、烧碱、纯碱、苛性钠、小苏打”所代表的物质(或主要成分)共有( )A、一种 B、二种 C、三种 D、四种6. 某同学用pH试纸测定了生活中一些物质的pH如下,其中能使酚酞试液变红的是( )
物质
苹果汁
酱油
食盐水
炉具清洁剂
pH
3
5
7
12
A、食盐水 B、炉具清洁剂 C、苹果汁 D、酱油7. “劳动创造幸福,实干成就伟业。”下列劳动所涉及的化学知识正确的是( )选项
劳动项目
化学知识
A
用明矾处理较浑浊的天然水
明矾主要起杀菌消毒作用
B
煮水时,若水的硬度大,易结垢
硬水中含有较多可溶性钙、镁化合物
C
在盐田中晾晒海水,得到粗盐
粗盐除去泥沙即可得到纯净的氯化钠
D
向膨化食品包装袋中充入氮气
氮气的密度和空气密度相近
A、A B、B C、C D、D8. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、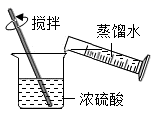 稀释浓硫酸
B、
稀释浓硫酸
B、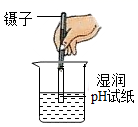 测稀硫酸的pH
C、
测稀硫酸的pH
C、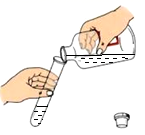 倾倒稀硫酸
D、
倾倒稀硫酸
D、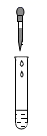 滴加稀硫酸
9. 某化学兴趣小组为探究铝、铜、银三种金属的活动性顺序,利用实验室中的相关药品设计了如下实验方案(实验用到的三种金属丝均已打磨干净):
滴加稀硫酸
9. 某化学兴趣小组为探究铝、铜、银三种金属的活动性顺序,利用实验室中的相关药品设计了如下实验方案(实验用到的三种金属丝均已打磨干净):①稀盐酸、铝、铜、银
②硫酸铜溶液、铝、银
③硫酸铝溶液、铜、银
④硝酸银溶液、铝、铜
⑤硫酸铝溶液、硝酸银溶液、铜
其中能验证铝、铜、银金属活动性顺序的是( )
A、②③⑤ B、①②③ C、②④⑤ D、①③④10. 在密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,在不同时刻测得各物质的质量(单位为g)如表所示。下列说法错误的是( )甲
乙
丙
丁
反应前
20
64
6
10
反应中
a
48
c
19
反应后
4
b
50
46
A、a=16 B、丙和丁为生成物 C、甲和丙的质量变化量之比为4∶11 D、若乙和丙的相对分子质量为32和44,则乙和丙的化学计量数之比为1∶211. 归纳推理是化学学习中常用的思维方法,下列推理正确的是( )A、常温下,pH<7的溶液显酸性,因此pH<7的雨水一定都是酸雨 B、单质是由一种元素组成的物质,因此由一种元素组成的物质一定是单质 C、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 D、酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定呈酸性12. 下列物质在给定条件下能实现转化的是( )A、 B、 C、 D、二、多选题
-
13. 下列说法错误的是( )A、铝制品耐腐蚀性很强是因为铝的化学性质不活泼 B、洗涤剂对油污具有乳化作用,在厨房中可用来清洗碗筷 C、在pH=3的溶液中:NaCl、Na2CO3、NaOH不能大量共存 D、物质在空气中燃烧生成二氧化碳和水,可以证明该物质一定含有碳、氢、氧元素14. 下列实验方案设计正确的是( )
选项
实验目的
实验方案
A
检验氢氧化钠溶液中是否含有少量的氢氧化钙
取少量溶液加入适量碳酸钠溶液,观察是否有沉淀生成
B
鉴别硝酸银和硫酸钠
取样,溶解在水中,再滴加氯化钡溶液和足量稀硝酸,观察是否有沉淀生成
C
除去稀盐酸中混有的少量硫酸
加入适量的氯化钡溶液,过滤
D
分离碳酸钠和氯化钠的混合物
加入适量氯化钙溶液,过滤,蒸发
A、A B、B C、C D、D15. 下列所示的四个图像能正确反映对应变化关系的是( )A、 气体物质的溶解度与温度和压强的关系
B、
气体物质的溶解度与温度和压强的关系
B、 向等质量的镁和锌中加入稀盐酸至过量
C、
向等质量的镁和锌中加入稀盐酸至过量
C、 向pH=12的氢氧化钠溶液中加入pH=2的稀盐酸
D、
向pH=12的氢氧化钠溶液中加入pH=2的稀盐酸
D、 向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸
向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸
三、填空题
-
16. 人类的生活离不开化学。从下列选项中选择一种适当的物质填空,并将序号填写在横线上。
①水果②钛合金③湿毛巾④碳酸氢钠⑤医用酒精⑥点燃的蜡烛
(1)、健康:食用以预防坏血病;可用擦拭物品消毒。(2)、医疗:可用治疗胃酸过多;可用制造人造骨骼。(3)、安全:取用捂口逃离火场;取用探查废弃地窖。17. 在宏观、微观和符号之间建立联系是化学学科的重要思维方式。根据下列原子结构示意图及原子在周期表中的相关信息,回答下列问题: (1)、写出氢离子的符号。(2)、铝原子在化学变化中容易(填“得到”或者“失去”)电子。铝的应用很广泛,在高温下,铝与三氧化二铬反应可置换出金属铬(Cr),写出该反应的化学方程式。(3)、氮元素和氧元素的本质区别是不同。(4)、氨气是一种重要的化工原料,如下图是氮气和氢气反应生成氨气的微观示意图:
(1)、写出氢离子的符号。(2)、铝原子在化学变化中容易(填“得到”或者“失去”)电子。铝的应用很广泛,在高温下,铝与三氧化二铬反应可置换出金属铬(Cr),写出该反应的化学方程式。(3)、氮元素和氧元素的本质区别是不同。(4)、氨气是一种重要的化工原料,如下图是氮气和氢气反应生成氨气的微观示意图:
请写出此反应的化学方程式。
18. 化学使世界变得更加绚丽多彩。(1)、生活中,净化水的操作有:①过滤②蒸馏③静置沉淀等多种,其中净化程度最高的操作是(填序号)。净水器中经常使用活性炭,主要利用活性炭的性。(2)、农业上,利用水和氯化钠配制50kg溶质质量分数为16%的氯化钠溶液来选种。①配制过程有以下步骤:a、称量及量取b、计算c、溶解d、装瓶贴标签,正确顺序是(填序号)。
②将50kg质量分数为16%的氯化钠溶液,稀释成8%的氯化钠溶液,需要加水kg。
(3)、酒精灯是实验室常用的加热设备。用完酒精灯后,必须用灯帽盖灭,熄灭火焰的主要原理是____(填字母)。A、降温到着火点以下 B、隔绝空气 C、清除可燃物(4)、金属在科技领域发挥着极其重要的作用。①国产大飞机C919机壳采用了铝锂合金材料。铝锂合金的硬度比铝的硬度(填“大”或“小”)。
②建造航母用到钛合金,钛合金属于(填“纯净物”或“混合物”)。工业制钛其中一步反应为: , X的化学式。
19. 写出下列反应的化学方程式(1)、红磷在氧气中燃烧。(2)、锌和稀硫酸反应制氢气。(3)、实验室用过氧化氢溶液和二氧化锰制氧气。20. 甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答: (1)、P点的含义是。(2)、t3℃时,50g水与50g甲混合,所得溶液的质量为g。(3)、t1℃时甲、乙和丙三种物质的饱和溶液分别升温至t2℃,有晶体析出的是。(4)、欲使乙的饱和溶液变为不饱和溶液,可以采取的措施是(任写一种)。(5)、将100gt2℃甲的饱和溶液分别进行如下操作,所得溶液与原溶液相比,变化结果全部正确的是____(填字母)。
(1)、P点的含义是。(2)、t3℃时,50g水与50g甲混合,所得溶液的质量为g。(3)、t1℃时甲、乙和丙三种物质的饱和溶液分别升温至t2℃,有晶体析出的是。(4)、欲使乙的饱和溶液变为不饱和溶液,可以采取的措施是(任写一种)。(5)、将100gt2℃甲的饱和溶液分别进行如下操作,所得溶液与原溶液相比,变化结果全部正确的是____(填字母)。选项
操作
甲的溶解度
溶质质量
溶液质量
溶质的质量分数
A
从t2℃升温至t3℃
变大
变大
变大
不变
B
从t2℃降温至t1℃
变小
变小
变小
不变
C
恒温蒸发10g水
不变
变小
变小
不变
D
保持t2℃不变,再加入10g甲固体
变大
不变
变大
变大
A、A B、B C、C D、D21. 随着世界人口的增长,人类对农产品需求量增大,增施化肥逐渐成为农作物增产的最有力措施。NH4HCO3、NH4Cl、K2SO4、KCl都是常见的化肥。(1)、化肥能为农作物补充的营养元素主要有三种,上述化肥不能提供的营养元素是。(2)、有一包用剩的肥料,可能含有上述四种化肥中的一种或几种,为确定其成分,进行了如下实验:a、取少量肥料样品于研钵中,加入少量熟石灰混合研磨,有刺激性气味。
b、取少量肥料样品于烧杯中,加水溶解,得到无色溶液A。
c、取少量溶液A于试管中,滴加AgNO3溶液,有白色沉淀产生。
d、取少量溶液A于试管中,滴加BaCl2溶液,无明显现象。
e、取少量溶液A于试管中,滴加稀盐酸,无明显现象。
①分析上述实验过程,可得该肥料一定有 , 一定没有 , 可能有。
②实验a~e中,不必要进行的一项是(填标号)。
③设计实验方案进一步确定该肥料的成分,完成下表。(已知:)
实验操作
预期现象与结论
取少量样品于试管中,并加热至无刺激性气味的气体产生为止,待冷却后,加入足量的水溶解后,往试管里加入少量溶液,振荡后观察现象。
若 , 则该肥料的成分是NH4Cl、KCl。
22. 实验室现有大理石、高锰酸钾、稀盐酸等药品及相关仪器和用品,请结合下列装置回答问题: (1)、Ⅰ、用大理石和稀盐酸制取二氧化碳:
(1)、Ⅰ、用大理石和稀盐酸制取二氧化碳:发生反应的化学方程式为。
(2)、实验室通常选用的收集装置是(填字母)。(3)、若制取较干燥的二氧化碳,需要在发生装置和收集装置之间连接E装置,气体应从(填“b”或“c”)导管口进入。(4)、B装置中,当反应开始后,锥形瓶内气体增多,气压增大,大于外界大气压,导致长颈漏斗内液面(填“高于”或“低于”)锥形瓶内液面。(5)、Ⅱ、用高锰酸钾制取氧气:仪器a的名称是。
(6)、良好的实验习惯及合理的做法,是实验安全、环保和顺利进行的保证。①A装置开始加热时,应先使试管受热,然后再对药品所在的部位加热。
②为减少硫在氧气中燃烧的生成物对空气造成的污染,用排水法收集氧气时,应在集气瓶中预留。
23. 滨海新区地处渤海之滨,海水资源是天然的资源宝库。(1)、“杂交水稻之父”袁隆平“一稻济天下”,在不断培育高产杂交水稻的同时,还成功培育出了适宜在盐碱地上种植的“海水稻”。①“杂交水稻”富含淀粉,淀粉属于六大基本营养素中的。
②“海水稻”富含硒,硒是人体必需的(选填“微量”或“常量”)元素。
(2)、除去氯化钠溶液中杂质。为了除去NaCl溶液中含有少量的MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。
回答下列问题:
①实验Ⅰ中加入试剂A除去的杂质是。
②实验Ⅱ中加入的试剂B是溶液。
③滤液②中含有的阴离子有(填数字)种。
④实验Ⅲ中发生的中和反应的化学方程式。
24. 有一包固体样品可能是由NaOH、CaCO3、K2SO4、CuSO4、MgSO4中的一种或几种组成。某兴趣小组同学为了确定其成分,进行如图实验:
请回答:
(1)、生成气体b是(写化学式)。(2)、白色固体a的成分是(写化学式)。(3)、固体样品中一定没有。(4)、生成白色沉淀c的反应的化学方程式为。四、计算题
-
25. 血清素(C10H12N2O)是调节神经活动的重要物质。人体分泌血清素时,会头脑清醒,记忆力增强。阳光、运动、朗读能促进其分泌。请完成下列计算。(1)、血清素中含有(填数字)种元素。(2)、血清素分子中碳、氢原子的个数比为(写最简比)。(3)、血清素中氮元素和氧元素的质量比为(写最简比)。(4)、88g血清素中氮元素的质量为g。26. 我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了杰出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠。现有纯碱样品,为测定该样品中碳酸钠的质量分数,已称取样品12g,放入80g水中使其完全溶解,再加入稀盐酸43.4g,恰好完全反应,气体全部逸出,得到氯化钠的不饱和溶液131g。请计算:(1)、生成二氧化碳的质量。(2)、样品中碳酸钠的质量分数(计算结果精确到0.1%)。(3)、反应后所得溶液中溶质的质量分数。