北京市密云区2022年中考二模化学试题
试卷更新日期:2022-07-22 类型:中考模拟
一、单选题
-
1. 空气成分中,可供给动植物呼吸的是( )A、氧气 B、氮气 C、稀有气体 D、二氧化碳2. 下列人体所必须的元素中,青少年缺少会引起佝偻病的是( )A、钙 B、铁 C、锌 D、碘3. 下列属于溶液的是( )A、生理盐水 B、冰水 C、豆浆 D、牛奶4. 下列废弃物品可以投放到如图所示垃圾桶的是( )
 A、废电池
A、废电池 B、废口罩
B、废口罩 C、易拉罐
C、易拉罐 D、苹果皮
D、苹果皮 5. 如图所示的图标表示( )
5. 如图所示的图标表示( ) A、禁止吸烟 B、禁止燃放鞭炮 C、禁止带火种 D、禁止堆放易燃物6. 下列不属于化石能源的是( )A、煤 B、太阳能 C、石油 D、天然气7. 下列实验发生化学变化的是( )
A、禁止吸烟 B、禁止燃放鞭炮 C、禁止带火种 D、禁止堆放易燃物6. 下列不属于化石能源的是( )A、煤 B、太阳能 C、石油 D、天然气7. 下列实验发生化学变化的是( )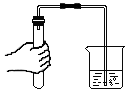

A.检查装置气密性
B.用简易净水器净水


C.比较合金和纯金属的硬度
D.模拟简易灭火器
A、A B、B C、C D、D8. 下列物质在氧气中燃烧产生大量白烟的是( )A、红磷 B、木炭 C、铁丝 D、石蜡9. 电解水实验如图,下列说法错误的是( ) A、试管1中得到H2 B、水由H2、O2构成 C、连接正、负极的集气管内收集的气体体积比为1:2 D、水由氢、氧元素组成10. 下列二氧化碳的用途中,错误的是( )A、冶炼金属 B、用作气体肥料 C、固体可作制冷剂 D、生产碳酸饮料11. 下列金属不能与CuSO4溶液反应的是( )A、Ag B、Fe C、Zn D、Al12. 氢氧化钠的俗称是( )A、火碱 B、纯碱 C、消石灰 D、小苏打13. 一些物质的pH范围如下,其中呈碱性的是( )A、柠檬汁(2-3) B、酱油(4-5) C、西瓜汁(5-6) D、洗发水(8-9)14. 下列符号能表示2个氯分子的是( )A、Cl2 B、2Cl2 C、2Cl D、2Cl-15. 下列物质的化学式书写正确的是( )A、氯化铁FeCl2 B、氧化镁MgO2 C、硫酸铜CuSO4 D、氯化铝AlCl16. “含氟牙膏”中“氟”指的是( )A、原子 B、分子 C、元素 D、单质17. 已知一种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则核外电子数为( )A、2 B、6 C、8 D、1418. 地壳中含有丰富的氧、硅、铝、铁等元素。结合下图分析,关于这四种元素的说法正确的是( )
A、试管1中得到H2 B、水由H2、O2构成 C、连接正、负极的集气管内收集的气体体积比为1:2 D、水由氢、氧元素组成10. 下列二氧化碳的用途中,错误的是( )A、冶炼金属 B、用作气体肥料 C、固体可作制冷剂 D、生产碳酸饮料11. 下列金属不能与CuSO4溶液反应的是( )A、Ag B、Fe C、Zn D、Al12. 氢氧化钠的俗称是( )A、火碱 B、纯碱 C、消石灰 D、小苏打13. 一些物质的pH范围如下,其中呈碱性的是( )A、柠檬汁(2-3) B、酱油(4-5) C、西瓜汁(5-6) D、洗发水(8-9)14. 下列符号能表示2个氯分子的是( )A、Cl2 B、2Cl2 C、2Cl D、2Cl-15. 下列物质的化学式书写正确的是( )A、氯化铁FeCl2 B、氧化镁MgO2 C、硫酸铜CuSO4 D、氯化铝AlCl16. “含氟牙膏”中“氟”指的是( )A、原子 B、分子 C、元素 D、单质17. 已知一种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则核外电子数为( )A、2 B、6 C、8 D、1418. 地壳中含有丰富的氧、硅、铝、铁等元素。结合下图分析,关于这四种元素的说法正确的是( ) A、氧原子的核电荷数为8 B、硅元素属于金属元素 C、铝原子在化学反应中易得电子 D、铁的相对原子质量为55.85g19. 下列物质中,属于氧化物的是( )A、CO2 B、KMnO4 C、O2 D、Ca(OH)220. 下列实验操作中错误的是( )A、用纸槽取用粉末
A、氧原子的核电荷数为8 B、硅元素属于金属元素 C、铝原子在化学反应中易得电子 D、铁的相对原子质量为55.85g19. 下列物质中,属于氧化物的是( )A、CO2 B、KMnO4 C、O2 D、Ca(OH)220. 下列实验操作中错误的是( )A、用纸槽取用粉末 B、测定溶液pH值
B、测定溶液pH值 C、读取液体体积
C、读取液体体积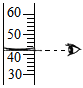 D、稀释浓硫酸
D、稀释浓硫酸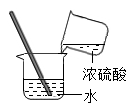 21. 市场上一些橡皮、涂改液里的甲苯(化学式C7H8 , 分子结构如图)严重超标,甲苯低毒,属于致癌物。下列有关甲苯的说法错误的是( )
21. 市场上一些橡皮、涂改液里的甲苯(化学式C7H8 , 分子结构如图)严重超标,甲苯低毒,属于致癌物。下列有关甲苯的说法错误的是( ) A、甲苯是有机化合物 B、甲苯分子中碳、氢原子的个数比为7:8 C、甲苯分子中碳元素的质量分数最大 D、甲苯分子的相对分子质量为1322. 药物“胃舒平”治疗胃酸过多的原理为 , 该反应属于( )A、复分解反应 B、分解反应 C、置换反应 D、化合反应23. 如图是甲、乙两种固体物质的溶解度曲线,下列说法中正确的是( )
A、甲苯是有机化合物 B、甲苯分子中碳、氢原子的个数比为7:8 C、甲苯分子中碳元素的质量分数最大 D、甲苯分子的相对分子质量为1322. 药物“胃舒平”治疗胃酸过多的原理为 , 该反应属于( )A、复分解反应 B、分解反应 C、置换反应 D、化合反应23. 如图是甲、乙两种固体物质的溶解度曲线,下列说法中正确的是( ) A、甲中混有少量乙,可以用蒸发溶剂的方法得到甲 B、把100g溶质质量分数为5%的甲溶液从t2℃降温到t1℃,其溶质质量分数仍为5% C、甲的溶解能力比乙强 D、t2℃时,将甲、乙溶液恒温蒸发等质量的水,析出晶体的质量相同24. 下图为某化学反应的微观示意图,且各微粒恰好完全反应,其中“
A、甲中混有少量乙,可以用蒸发溶剂的方法得到甲 B、把100g溶质质量分数为5%的甲溶液从t2℃降温到t1℃,其溶质质量分数仍为5% C、甲的溶解能力比乙强 D、t2℃时,将甲、乙溶液恒温蒸发等质量的水,析出晶体的质量相同24. 下图为某化学反应的微观示意图,且各微粒恰好完全反应,其中“ ”、“
”、“ ”、“
”、“ ”分别代表不同元素的原子,则构成反应物X的微粒中( )
”分别代表不同元素的原子,则构成反应物X的微粒中( ) A、一定含有
A、一定含有 和
和 B、一定含有
B、一定含有 和
和 C、只有
C、只有 D、只有
D、只有 25. 通常情况下,几种物质的着火点如下表。
25. 通常情况下,几种物质的着火点如下表。物质
白磷
红磷
铁粉
砂糖
着火点/℃
40
240
315~320
350
根据上表所给信息和所学相关知识判断,下列说法错误的是( )
A、白磷、红磷、铁粉、砂糖都是可燃物 B、降低可燃物的着火点可以达到灭火的目的 C、相同条件下,铁粉比砂糖更易点燃 D、通常情况下,红磷燃烧需要与氧气接触、温度达到240℃或以上二、课内填空
-
26. 补齐连线。从A或B中任选一个作答,若均作答,按A计分。
A物质——用途
B物质——主要成分
盐酸 除铁锈
碳酸钙 改良酸性土壤
熟石灰 补钙剂
天然气 甲烷
生石灰 氯化钠
食盐 氧化钙
27. “拜拜甜甜圈”,对于需要控制体重的人群要减少“甜食”的摄入,因为这类食物中通常都含有大量(填写一种营养素的名称),一旦摄入的这种营养素不能被及时消耗,就会转化为脂肪囤积在身体里。 28. 2022年北京冬奥会火炬——飞扬,是奥运会历史上最小的主火炬,也是冬奥历史上首支采用氢气做主燃料的火炬。写出氢气燃烧的化学反应方程式。相比往届冬奥会采用丙烷(C3H6)+丁烷(C4H8)做燃料,用氢气做燃料的优点是。(写出一点即可)
28. 2022年北京冬奥会火炬——飞扬,是奥运会历史上最小的主火炬,也是冬奥历史上首支采用氢气做主燃料的火炬。写出氢气燃烧的化学反应方程式。相比往届冬奥会采用丙烷(C3H6)+丁烷(C4H8)做燃料,用氢气做燃料的优点是。(写出一点即可) 29. 下列生活中一些常见的说法,你认为其中没有科学性错误的是____(填序号)。A、铅笔芯的黑色是由于其成分是铅,儿童用嘴咬铅笔会导致铅中毒 B、在生有煤炉的居室里放一盆水,可以防止CO中毒 C、在农作物温室大棚内燃烧煤,产生的CO2不利于植物的生长 D、露天放置的大型金属设备表面涂漆,可以起到隔绝氧气防止锈蚀的的作用30. 3月22-28日是第三十五届“中国水周”。下列做法不利于水资源保护的是____(填序号)。
29. 下列生活中一些常见的说法,你认为其中没有科学性错误的是____(填序号)。A、铅笔芯的黑色是由于其成分是铅,儿童用嘴咬铅笔会导致铅中毒 B、在生有煤炉的居室里放一盆水,可以防止CO中毒 C、在农作物温室大棚内燃烧煤,产生的CO2不利于植物的生长 D、露天放置的大型金属设备表面涂漆,可以起到隔绝氧气防止锈蚀的的作用30. 3月22-28日是第三十五届“中国水周”。下列做法不利于水资源保护的是____(填序号)。 A、工业废水处理后可循环使用 B、发展水产养殖 C、园林浇灌用滴灌、喷灌 D、在湖河沿岸空余滩地填埋垃圾腐肥31. 实验室配制100g溶质质量分数为5%的氯化钠溶液。实验操作如下:
A、工业废水处理后可循环使用 B、发展水产养殖 C、园林浇灌用滴灌、喷灌 D、在湖河沿岸空余滩地填埋垃圾腐肥31. 实验室配制100g溶质质量分数为5%的氯化钠溶液。实验操作如下: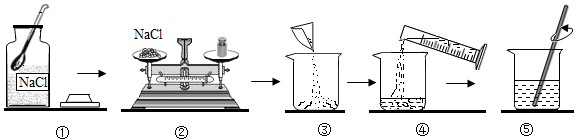 (1)、需要称量氯化钠的质量是g。(2)、操作④中量筒的量程是(填“10 mL”、“50 mL”或“100 mL”)。(3)、若操作③中有部分固体洒落桌面,所得溶液的溶质质量分数会(填“偏大”、“不变”或“偏小”)。(4)、步骤⑤中用玻璃棒搅拌的目的是。32. 如图,小亮同学在实验室完成“铁丝在氧气中燃烧”实验。
(1)、需要称量氯化钠的质量是g。(2)、操作④中量筒的量程是(填“10 mL”、“50 mL”或“100 mL”)。(3)、若操作③中有部分固体洒落桌面,所得溶液的溶质质量分数会(填“偏大”、“不变”或“偏小”)。(4)、步骤⑤中用玻璃棒搅拌的目的是。32. 如图,小亮同学在实验室完成“铁丝在氧气中燃烧”实验。 (1)、为了防止高温的熔融物掉落使瓶底炸裂,可采取的操作是。(2)、为了探究反应后所得黑色固体中是否含有铁,小亮将冷却后的黑色物质碾碎,装入试管,加入溶液,观察到的现象,说明铁燃烧后得到的黑色物质中含有铁。33. 某兴趣学习小组在学习碱的化学性质时,进行了如图所示的实验:
(1)、为了防止高温的熔融物掉落使瓶底炸裂,可采取的操作是。(2)、为了探究反应后所得黑色固体中是否含有铁,小亮将冷却后的黑色物质碾碎,装入试管,加入溶液,观察到的现象,说明铁燃烧后得到的黑色物质中含有铁。33. 某兴趣学习小组在学习碱的化学性质时,进行了如图所示的实验: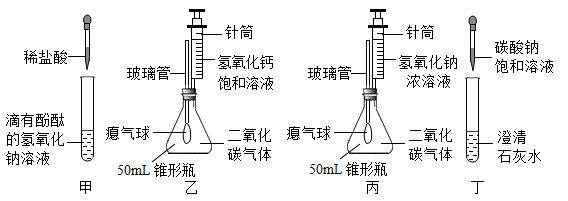 (1)、写出甲实验中观察到的现象是:。(2)、丙实验中滴加氢氧化钠溶液后,锥形瓶中气球的变化是。(3)、丁实验中发生反应的化学方程式为。(4)、同时向乙和丙装置中分别注入5mL氢氧化钙饱和溶液、5mL40%的氢氧化钠浓溶液(如图),乙和丙中观察到的不同现象有 , 产生这些不同现象的主要原因是。
(1)、写出甲实验中观察到的现象是:。(2)、丙实验中滴加氢氧化钠溶液后,锥形瓶中气球的变化是。(3)、丁实验中发生反应的化学方程式为。(4)、同时向乙和丙装置中分别注入5mL氢氧化钙饱和溶液、5mL40%的氢氧化钠浓溶液(如图),乙和丙中观察到的不同现象有 , 产生这些不同现象的主要原因是。三、科普阅读题
-
34. 阅读下面科普短文。
生活中我们谈到“细菌”往往会心惊胆战。其实细菌不是只有危险的一面,如果掌握了它们的特性,很多细菌也可以为我们服务。

氧化亚铁硫杆菌(以下简称为T·f菌,见图1)是一种细菌,它被广泛应用于治理废气、废渣等有害物质。例如用T·f菌脱除工业废气中的一种有毒、有腐蚀性的气体——硫化氢(H2S)。其作用原理如右图2所示。
这个净化过程中,Fe2(SO4)3溶液在常温常压下就可以将废气中的H2S脱出,生成FeSO4.FeSO4在酸性溶液中、在T·f菌的帮助之下,只需少量的氧气就又可以转化为Fe2(SO4)3 , 同时释放的能量还能供给T·f菌生长。
用这种方法处理废气大大降低了治污的成本,脱除率达到99.97%,且无废物排出。但要达到高效的关键是要保证体系内FeSO4浓度的稳定,一旦FeSO4浓度降低,T·f菌就会像缺少食物一样逐渐失去活性。
实际应用过程发现Fe2(SO4)3在pH=1.9时会发生一定的变化,生成了铁的沉淀物——黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕,并在pH=3.2时沉淀完全,使得溶液中的总铁浓度下降,降低了对废气的吸收效率。
可见溶液的pH值对这个方法的效果有一定影响。实验测得30℃时,不同pH环境下T·f菌的活性也不同,表现为FeSO4溶液转化为Fe2(SO4)3溶液的速率不同,如下表:
pH
0.9
1.2
1.5
1.9
2.1
2.4
2.7
3.0
FeSO4溶液转化为Fe2(SO4)3速率/(g·L-1·h-1)
4.5
5.3
6.2
6.8
7.0
6.6
6.2
5.6
回答下列问题:
(1)、在环节①中硫元素的化合价呈现-2、、+6多种价态。(2)、环节②的反应原理为: , 其中物质“X”的化学式为。(3)、黄铵铁矾〔NH4Fe3(SO4)2(OH)6〕的化学式中“3”表示的个数。(填写序号)A.铁元素 B.铁原子 C.铁分子(4)、用T·f菌脱除废气中的H2S气体的优点是(写出1点即可)。(5)、请结合文中信息,判断工业用T·f菌脱硫应选择的最佳pH范围是<pH<。四、综合题
-
35. 高纯CO可用于半导体领域某些芯片的刻蚀,利用甲酸(HCOOH)制取高纯CO的主要流程如图:
 (1)、甲酸中含有种元素。(2)、反应器中甲酸发生分解反应,生成一氧化碳和水,写出此反应的化学方程式。(3)、同时,反应器中还会发生副反应产生微量的CO2气体,这些CO2是在(填写设备名称)中被除去。36. 以镁矿石(主要成分为MgCO3和SiO2 , 其中SiO2难溶于水和常见的酸)为原料生产MgO的工艺流程如图,回答问题:
(1)、甲酸中含有种元素。(2)、反应器中甲酸发生分解反应,生成一氧化碳和水,写出此反应的化学方程式。(3)、同时,反应器中还会发生副反应产生微量的CO2气体,这些CO2是在(填写设备名称)中被除去。36. 以镁矿石(主要成分为MgCO3和SiO2 , 其中SiO2难溶于水和常见的酸)为原料生产MgO的工艺流程如图,回答问题:
 (1)、在“酸浸”环节加入过量稀硫酸的目的是。(2)、“沉镁”环节物料之间反生了复分解反应: , “沉镁”后过滤(Ⅱ)所得的滤液中一定不含有硫酸,理由是。(3)、“加热”环节,在不同温度下,充分加热等质量的Mg(OH)2 , 测得如图2是所示容器内剩余固体质量变化情况。“加热”时温度至少要达到350℃,原因是。37. 根据实验装置图回答问题。
(1)、在“酸浸”环节加入过量稀硫酸的目的是。(2)、“沉镁”环节物料之间反生了复分解反应: , “沉镁”后过滤(Ⅱ)所得的滤液中一定不含有硫酸,理由是。(3)、“加热”环节,在不同温度下,充分加热等质量的Mg(OH)2 , 测得如图2是所示容器内剩余固体质量变化情况。“加热”时温度至少要达到350℃,原因是。37. 根据实验装置图回答问题。 (1)、写出标有序号“①”的仪器名称:①。(2)、若用高锰酸钾制取干燥的氧气,选择的装置组合是(填仪器的字母序号),该反应的化学方程式为。实验中,为了防止高锰酸钾粉末随气体进入导管,需要对A装置进行一点改进是。(填写序号)
(1)、写出标有序号“①”的仪器名称:①。(2)、若用高锰酸钾制取干燥的氧气,选择的装置组合是(填仪器的字母序号),该反应的化学方程式为。实验中,为了防止高锰酸钾粉末随气体进入导管,需要对A装置进行一点改进是。(填写序号)A.将试管口向上倾斜 B.在试管口放少量棉花 C.撤去酒精灯
(3)、用B装置制备二氧化碳,锥形瓶内盛放的固体药品是(填写药品名称)。(4)、某气体只能用E装置收集,则该气体不可能具有的性质是____(填写序号)。A、易溶于水或与水反应 B、能与空气反应 C、密度与空气接近38. 某兴趣小组对铁生锈的影响因素进行探究。(1)、实验1:探究铁生锈的条件【进行实验】
如图所示,取三根洁净无锈的铁钉,分别放置在三个不同环境中,一周后观察铁钉生锈情况并记录如下。

实验
A
B
C
现象
在液面附近,铁钉生锈严重
铁钉无明显变化
铁钉无明显变化
【解释与结论】
对比实验(填序号),可以得出铁生锈与水有关。
(2)、由上述实验可知,铁生锈的条件是。(3)、实验2:探究NaCl溶液的浓度对铁生锈速率的影响【进行实验】
室温下,取大小、形状相同的光亮铁丝,用下图装置完成实验并记录如下。

实验
编号
烧瓶内液体(用于浸润铁丝)用量
放置不同时间,导管内液面上升高度(cm)
1小时
2小时
3小时
①
2.0mL蒸馏水
0.1
0.7
3.2
②
1.5mL蒸馏水+0.5mL10%NaCl溶液
0.3
1.5
5.0
③
1.0mL蒸馏水+amL10%NaCl溶液
0.8
3.3
7.9
④
0.5mL蒸馏水+1.5mL10%NaCl溶液
1.1
4.7
9.1
⑤
2mL10%NaCl溶液
0
0
0
【解释与结论】
导管内液面上升的原因是。
(4)、a=。(5)、依据实验①~④,可以得出的结论是。(6)、【反思与评价】小组同学重复实验⑤,得到以下数据:
烧瓶内液体(用于浸润铁丝)用量
放置不同时间,导管内液面上升高度(cm)
1小时
2小时
3小时
2mL10%NaCl溶液
1.4
5.7
10.0
则原实验⑤失败的可能原因是。
(7)、综合上述实验结果,铁制品的防护需尽量避免与水、氧气、接触。五、计算题
-
39. 过氧化钙(CaO2)是一种化学增氧剂,其反应原理为:。
计算:要制备3.2kg氧气,至少需要取过氧化钙的质量是多少?
-