江苏省徐州市2021-2022学年高二下学期期末抽测化学试题
试卷更新日期:2022-07-14 类型:期末考试
一、单选题
-
1. 北京冬奥会火种灯的外形设计灵感来自于西汉的“长信宫灯”。下列说法正确的是( )
 A、青铜的硬度小于纯铜 B、两灯实物如图所示,所用燃料均为烃 C、铝合金表面氧化物薄膜可保护内部金属不被腐蚀 D、镏金层破损后生成铜锈的主要成分为2. 反应可用于制备火箭推进剂的然料。下列有关说法正确的是( )A、的结构式:
A、青铜的硬度小于纯铜 B、两灯实物如图所示,所用燃料均为烃 C、铝合金表面氧化物薄膜可保护内部金属不被腐蚀 D、镏金层破损后生成铜锈的主要成分为2. 反应可用于制备火箭推进剂的然料。下列有关说法正确的是( )A、的结构式: B、基态氮原子轨道表示式:
B、基态氮原子轨道表示式: C、的电子式:
C、的电子式: D、中子数为8的氧原子:
3. 下列说法中正确的是( )A、含离子键,在熔融状态下能导电 B、轨道上的电子一定比轨道能量高 C、价电子越多的金属元素的金属性越强 D、第四周期元素的基态原子中,未成对电子数最多的是4. 下列选项中,X、Y两元素肯定属于同族且性质相似的是( )A、原子核外电子排布式:X为 , Y为 B、结构示意图:X为
D、中子数为8的氧原子:
3. 下列说法中正确的是( )A、含离子键,在熔融状态下能导电 B、轨道上的电子一定比轨道能量高 C、价电子越多的金属元素的金属性越强 D、第四周期元素的基态原子中,未成对电子数最多的是4. 下列选项中,X、Y两元素肯定属于同族且性质相似的是( )A、原子核外电子排布式:X为 , Y为 B、结构示意图:X为 , Y为
, Y为 C、X原子基态时轨道上只有1个未成对电子,Y原子基态时轨道上也只有1个未成对电子
D、X原子基态时轨道上只有一对成对电子,Y原子基态时轨道上也只有一对成对电子
5. 下列有关实验的说法正确的是( )
C、X原子基态时轨道上只有1个未成对电子,Y原子基态时轨道上也只有1个未成对电子
D、X原子基态时轨道上只有一对成对电子,Y原子基态时轨道上也只有一对成对电子
5. 下列有关实验的说法正确的是( ) A、用装置甲采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 B、装置乙记录滴定终点读数为 C、用装置丙在铁制品表面镀铜 D、用装置丁将溶液蒸干制得无水6. A、B、C、D四种短周期元素,A元素原子的外围电子排布式为 , B元素与A元素位于同一周期,其原子的核外有三个未成对电子,C元素位于第2周期,电负性仅小于氟,D元素在短周期元素中第一电离能最小。下列说法正确的是( )A、第一电离能: B、原子半径: C、C,D两种元素组成的化合物一定不含共价键 D、简单气态氢化物的热稳定性:7. 哈伯法合成氢的反应原理为 , 新研制的催化剂可使该反应在常温、常压下进行,以氮气和氢气为反应物的燃料电池是利用氮气的一种新方法。下列有关哈伯法合成氨反应的说法正确的是( )A、若该反应能自发进行,则 B、选用高效催化剂,可降低该反应的 C、其它条件不变,增大起始的比值,可提高的平衡转化率 D、提高体系的压强可增大反应的化学平衡常数8. 哈伯法合成氨的反应原理为 , 新研制的催化剂可使该反应在常温、常压下进行,以氮气和氢气为反应物的燃料电池是利用氮气的一种新方法。将上述合成氨反应设计成燃料电池,工作原理如图所示。其中溶有的稀的A溶液为电解质。下列说法错误的是( )
A、用装置甲采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 B、装置乙记录滴定终点读数为 C、用装置丙在铁制品表面镀铜 D、用装置丁将溶液蒸干制得无水6. A、B、C、D四种短周期元素,A元素原子的外围电子排布式为 , B元素与A元素位于同一周期,其原子的核外有三个未成对电子,C元素位于第2周期,电负性仅小于氟,D元素在短周期元素中第一电离能最小。下列说法正确的是( )A、第一电离能: B、原子半径: C、C,D两种元素组成的化合物一定不含共价键 D、简单气态氢化物的热稳定性:7. 哈伯法合成氢的反应原理为 , 新研制的催化剂可使该反应在常温、常压下进行,以氮气和氢气为反应物的燃料电池是利用氮气的一种新方法。下列有关哈伯法合成氨反应的说法正确的是( )A、若该反应能自发进行,则 B、选用高效催化剂,可降低该反应的 C、其它条件不变,增大起始的比值,可提高的平衡转化率 D、提高体系的压强可增大反应的化学平衡常数8. 哈伯法合成氨的反应原理为 , 新研制的催化剂可使该反应在常温、常压下进行,以氮气和氢气为反应物的燃料电池是利用氮气的一种新方法。将上述合成氨反应设计成燃料电池,工作原理如图所示。其中溶有的稀的A溶液为电解质。下列说法错误的是( ) A、b电极为负极 B、a电极发生的反应为 C、A溶液中所含溶质为 D、可用蒸发结晶的方法分离出A9. 哈伯法合成氢的反应原理为 , 新研制的催化剂可使该反应在常温、常压下进行,以氮气和氢气为反应物的燃料电池是利用氮气的一种新方法。我国科学家研制的高效固体催化剂 , 实现了在常温常压、可见光条件下“人工固氮”,其原理如图所示。下列有关说法错误的是( )
A、b电极为负极 B、a电极发生的反应为 C、A溶液中所含溶质为 D、可用蒸发结晶的方法分离出A9. 哈伯法合成氢的反应原理为 , 新研制的催化剂可使该反应在常温、常压下进行,以氮气和氢气为反应物的燃料电池是利用氮气的一种新方法。我国科学家研制的高效固体催化剂 , 实现了在常温常压、可见光条件下“人工固氮”,其原理如图所示。下列有关说法错误的是( )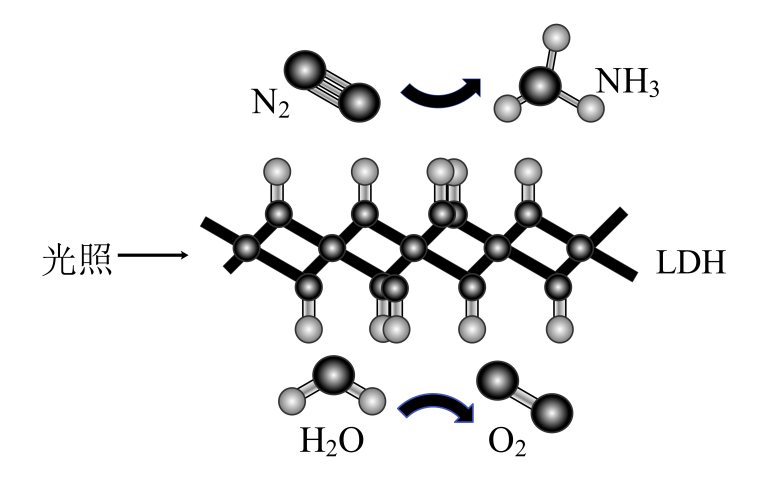 A、反应过程中存在共价键的断裂与形成 B、反应过程中存在太阳能转化为化学能 C、使用 , 可降低反应的活化能 D、反应生成时,电子转移了10. 利用铜矿石(主要成分为 , 还含少量 , , 制备晶体的流程如下图所示。已知在酸性条件下不稳定,易生成金属和 , 下列说法错误的是( )
A、反应过程中存在共价键的断裂与形成 B、反应过程中存在太阳能转化为化学能 C、使用 , 可降低反应的活化能 D、反应生成时,电子转移了10. 利用铜矿石(主要成分为 , 还含少量 , , 制备晶体的流程如下图所示。已知在酸性条件下不稳定,易生成金属和 , 下列说法错误的是( ) A、“滤渣1”的成分为、 B、“氧化”过程中的离子方程式: C、“调”所用的试剂a可选用 D、操作X为蒸发浓缩、冷却结晶、过滤、洗涤、干燥11. 根据下列图示所得出的结论错误的是( )
A、“滤渣1”的成分为、 B、“氧化”过程中的离子方程式: C、“调”所用的试剂a可选用 D、操作X为蒸发浓缩、冷却结晶、过滤、洗涤、干燥11. 根据下列图示所得出的结论错误的是( ) A、图甲是常温下用的溶液分别滴定一元酸、的滴定曲线,说明的酸性大于 B、图乙表示温度在和时水溶液中和的关系,则阴影部分M内任意一点均满足 C、图丙表示改变平衡体系的某一条件后,v(正)、v(逆)的变化情况,可推知时刻改变的条件是升高温度 D、图丁表示炭黑作用下生成活化氧过程中能量变化情况,说明每活化一个氧分子放出能量12. 辉铜矿(主要成分)可以用于制铜,化学反应方程式为 , 制得的粗铜(含等杂质)可通过电解法进行精炼,下列相关说法正确的是( )
A、图甲是常温下用的溶液分别滴定一元酸、的滴定曲线,说明的酸性大于 B、图乙表示温度在和时水溶液中和的关系,则阴影部分M内任意一点均满足 C、图丙表示改变平衡体系的某一条件后,v(正)、v(逆)的变化情况,可推知时刻改变的条件是升高温度 D、图丁表示炭黑作用下生成活化氧过程中能量变化情况,说明每活化一个氧分子放出能量12. 辉铜矿(主要成分)可以用于制铜,化学反应方程式为 , 制得的粗铜(含等杂质)可通过电解法进行精炼,下列相关说法正确的是( ) A、转化为基态 , 得到的电子填充在轨道上 B、S元素的电负性大于O元素的电负性 C、电解精炼铜时,粗铜应与电源的负极相连 D、如图所示的晶胞中,黑球表示的是13. 室温下,已知:、 , 通过下列实验研究溶液的性质。
A、转化为基态 , 得到的电子填充在轨道上 B、S元素的电负性大于O元素的电负性 C、电解精炼铜时,粗铜应与电源的负极相连 D、如图所示的晶胞中,黑球表示的是13. 室温下,已知:、 , 通过下列实验研究溶液的性质。实验1:向溶液中滴加一定量的溶液,测得混合溶液为7。
实验2:向溶液中通入一定量的 , 测得溶液为7。
实验3:向溶液中逐滴加入等体积溶液,测得溶液约为10。
实验4:向溶液中滴加少量溶液,产生白色沉淀。
下列说法正确的是( )
A、实验1混合溶液中 B、实验2所得溶液中存在 C、实验3操作过程中水的电离程度逐渐减小 D、实验4中反应的离子方程式为14. 若在催化剂作用下和合成甲酸主要涉及以下反应:
I.II.
在恒容密闭容器中,和各投发生反应,平衡时的转化率及和的选择性(产物的选择性:生成的或与转化的的比值)随温度变化如图所示。
下列说法正确的是( )
 A、反应II: B、曲线a表示平衡时的转化率 C、时,反应I的平衡常数 D、合成甲酸应选择在较高温度下甲酸选择性高的催化剂
A、反应II: B、曲线a表示平衡时的转化率 C、时,反应I的平衡常数 D、合成甲酸应选择在较高温度下甲酸选择性高的催化剂二、综合题
-
15. 铁元素被称为“人类第一元素”,铁及其化合物具有广泛的用途。(1)、水体中过量的是一种重要污染物,可利用纳米铁粉将其除去。
①基态铁原子核外电子排布式:;铁元素在元素周期表中的位置为 , 属于区元素。
②相同条件下,向含有的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉,的去除速率差异如图1所示,产生该差异的可能原因为。

 (2)、铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图2所示。储氢时,分子位于晶胞体心和棱的中心位置。
(2)、铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图2所示。储氢时,分子位于晶胞体心和棱的中心位置。①该晶胞中的配位数是。
②该合金储满氢后所得晶体的化学式是。
(3)、在生产中,常用处理的含(价)废水得到和。易被氧化为 , 请利用核外电子排布的相关原理解释其原因:。16. 以锰渣(含及少量、、元素的氧化物)和黄铁矿(主要成分为)为原料可制备和 , 过程可表示为: (1)、浸取:将锰渣与黄铁矿粉碎混合,用稀酸X浸取。研究发现,酸浸时,和颗粒参与反应的原理如图所示(部分产物未标出)。
(1)、浸取:将锰渣与黄铁矿粉碎混合,用稀酸X浸取。研究发现,酸浸时,和颗粒参与反应的原理如图所示(部分产物未标出)。
①所用的稀酸X是(填名称)。
②和颗粒参与反应的过程可描述为。
③若黄铁矿用量增加,锰的浸出率会降低,可能的原因是。
(2)、除铁铜:滤渣II的主要成分为(填化学式)。(3)、溶液和氨水混合溶液反应,生成沉淀。反应的离子方程式为。(4)、含量的测定:准确称取样品于锥形瓶中,加入草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,用溶液进行滴定,消耗溶液。测定过程中发生下列反应:计算样品的纯度(写出计算过程)。
17. 钴及其化合物在工业生产中有着广阔的应用前景。以溶液为原料可制备纳米钴粉和三氯化六氨合钴(价)晶体等。已知:①不易被氧化,具有强氧化性;具有较强还原性,性质稳定;
②水合肼易溶于水,具有强还原性,氧化产物为。
(1)、制备纳米钴粉:向溶液中加溶液调节溶液 , 再加入水合肼可以制取单质钴粉。已知不同的时(价)的物种分布图如图1所示。
①写出时制钴粉的离子方程式:。
②时,所制钴粉纯度会降低,其原因是。
(2)、制备实验步骤如下:I.称取研细的和于烧杯中溶解,将溶液转入三颈烧瓶,加入浓氨水和适量活性炭粉末,逐滴加入的溶液。实验装置如图2所示。

图-2
II.控制反应温度为 , 反应一段时间后,得溶液。
III.在一定条件下制得。
①仪器a的名称为。
②步骤I将转化过程中,先加浓氨水再加溶液目的是。
③步骤II中控制反应温度为的原因是。
(3)、制备晶体。请补充以溶液(含杂质、、)制各纯净的晶体实验方案:取一定量的溶液, , 干燥,得晶体。 (须使用试剂:溶液,溶液,溶液,溶液)18. 已知:①晶体难溶于水。②部分金属离子生成氢氧化物沉淀的如下表:
金属离子
开始沉淀的
7.6
7.6
2.7
4.0
沉淀完全的
9.2
9.6
3.7
5.2
烟气中含高浓度、氮氧化物等有害物质,在排放前须进行脱硫、脱硝处理。
(1)、利用反应 , 可实现汽车尾气的无害化处理。一定条件下进行该反应,测得的平衡转化率与温度、起始投料比的关系如图1所示。
①该反应的0(填“>”“<”或“=”)。
②图1中所示反应中,投料比最大的是(填“”、“”或“”)。
③随着温度的升高,不同投料比下平衡转化率趋于相近的原因是。
(2)、钠钙双碱法可高效脱除烟气中的 , 脱硫的流程如图2所示。
①“吸收”时气液逆流在吸收塔中接触,不宜直接使用石灰乳的原因是。
②水溶液中、、随的分布分数如图3所示,“再生液”用溶液调至7~9得到溶液X,溶液X吸收时主要反应的离子方程式为。
 (3)、用电解法处理氮氧化物可回收硝酸。实验室模拟电解的装置如图4所示。写出电解时阳极的电极反应式:。
(3)、用电解法处理氮氧化物可回收硝酸。实验室模拟电解的装置如图4所示。写出电解时阳极的电极反应式:。