江苏省扬州市2021-2022学年高一下学期期末调研化学试题
试卷更新日期:2022-07-14 类型:期末考试
一、单选题
-
1. 现代社会的发展与进步离不开材料,下列说法错误的是( )A、“辽宁舰”上用于舰载机降落的阻拦索是一种特种钢缆,属于合金材料 B、“超轻海绵”使用的石墨烯是有机高分子材料 C、速滑馆“冰丝带”使用二氧化碳跨临界制冰,二氧化碳由分子构成 D、“中国天眼”FAST使用碳化硅,碳化硅是无机非金属材料2. 氯化氢通入氨水中发生反应:NH3·H2O + HCl = NH4Cl + H2O。下列说法正确的是( )A、HCl的电子式:
 B、中子数为8的氮原子:
C、氯离子的结构示意图:
B、中子数为8的氮原子:
C、氯离子的结构示意图: D、反应类型:复分解反应
3. 下列物质属于共价化合物的是( )A、NH3 B、NH4Cl C、Cl2 D、KOH4. 下列关于乙烯的说法正确的是( )A、分子中存在碳碳双键 B、分子中C、H元素的质量比为1∶2 C、可用向上排空气法收集 D、不能使酸性KMnO4溶液褪色5. FeCl3溶液和KI溶液发生反应:2Fe3+ + 2I-2Fe2+ + I2。下列关于该反应的说法正确的是( )A、升高温度能减慢反应速率 B、增大Fe3+和I-的浓度能加快反应速率 C、反应达到平衡时,溶液中c(Fe3+)与c(Fe2+)相等 D、加入过量FeCl3溶液可使I-的转化率为100%6. 实验室制备、干燥、收集NH3并进行尾气处理,下列装置能达到实验目的的是( )
D、反应类型:复分解反应
3. 下列物质属于共价化合物的是( )A、NH3 B、NH4Cl C、Cl2 D、KOH4. 下列关于乙烯的说法正确的是( )A、分子中存在碳碳双键 B、分子中C、H元素的质量比为1∶2 C、可用向上排空气法收集 D、不能使酸性KMnO4溶液褪色5. FeCl3溶液和KI溶液发生反应:2Fe3+ + 2I-2Fe2+ + I2。下列关于该反应的说法正确的是( )A、升高温度能减慢反应速率 B、增大Fe3+和I-的浓度能加快反应速率 C、反应达到平衡时,溶液中c(Fe3+)与c(Fe2+)相等 D、加入过量FeCl3溶液可使I-的转化率为100%6. 实验室制备、干燥、收集NH3并进行尾气处理,下列装置能达到实验目的的是( ) A、用图1所示的装置制备NH3 B、用图2所示的装置干燥NH3 C、用图3所示的装置收集NH3 D、用图4所示的装置吸收多余NH37. 下列有关物质的性质与用途具有对应关系的是( )A、乙醇具有挥发性,可用于杀菌消毒 B、CCl4常温下无色,可用作萃取剂 C、甲烷燃烧时放出大量热,可用作燃料 D、液氨气化时吸热,可用作还原剂8. 某原电池装置如图所示,下列说法正确的是( )
A、用图1所示的装置制备NH3 B、用图2所示的装置干燥NH3 C、用图3所示的装置收集NH3 D、用图4所示的装置吸收多余NH37. 下列有关物质的性质与用途具有对应关系的是( )A、乙醇具有挥发性,可用于杀菌消毒 B、CCl4常温下无色,可用作萃取剂 C、甲烷燃烧时放出大量热,可用作燃料 D、液氨气化时吸热,可用作还原剂8. 某原电池装置如图所示,下列说法正确的是( ) A、Cu作负极 B、电子由Fe棒经导线流向Cu棒 C、Fe棒发生的电极反应:Fe -3e-= Fe3+ D、每生成22.4 L H2 , 转移电子2 mol9. 工业合成氨是人类科学技术的一项重大突破。N2与H2反应合成氨为可逆反应,其热化学方程式为N2(g) + 3H2(g) = 2NH3(g) ΔH = − 92.4 kJ∙mol−1。氨气经氧化等步骤制得硝酸。利用石灰乳、尿素等吸收硝酸工业的尾气(含NO、NO2),石灰乳吸收时主要反应为NO + NO2 + Ca(OH)2 = Ca(NO2)2 + H2O。N2、NH3在催化剂a、b表面分别发生如下图所示的反应,下列说法正确的是( )
A、Cu作负极 B、电子由Fe棒经导线流向Cu棒 C、Fe棒发生的电极反应:Fe -3e-= Fe3+ D、每生成22.4 L H2 , 转移电子2 mol9. 工业合成氨是人类科学技术的一项重大突破。N2与H2反应合成氨为可逆反应,其热化学方程式为N2(g) + 3H2(g) = 2NH3(g) ΔH = − 92.4 kJ∙mol−1。氨气经氧化等步骤制得硝酸。利用石灰乳、尿素等吸收硝酸工业的尾气(含NO、NO2),石灰乳吸收时主要反应为NO + NO2 + Ca(OH)2 = Ca(NO2)2 + H2O。N2、NH3在催化剂a、b表面分别发生如下图所示的反应,下列说法正确的是( ) A、催化剂a表面形成N-H键时需吸收能量 B、使用催化剂a可以加快合成氨反应的正反应速率,减慢逆反应速率 C、反应时催化剂b表面有共价键的断裂和形成 D、催化剂b表面反应的化学方程式为:10. 工业合成氨是人类科学技术的一项重大突破。N2与H2反应合成氨为可逆反应,其热化学方程式为N2(g) + 3H2(g) = 2NH3(g) ΔH = − 92.4 kJ∙mol−1。氨气经氧化等步骤制得硝酸。利用石灰乳、尿素等吸收硝酸工业的尾气(含NO、NO2),石灰乳吸收时主要反应为NO + NO2 + Ca(OH)2 = Ca(NO2)2 + H2O。下列关于氮氧化物的形成、吸收等说法正确的是( )A、汽车尾气中含氮氧化物,主要来源于烃类燃料 B、用石灰乳吸收NO和NO2 , 增加气体流速可提高氮氧化物的吸收率 C、收集NO2气体时采用排水法,可提高NO2气体的纯度 D、用CO(NH2)2可将NO2转化为N2 , 是利用了CO(NH2)2的还原性11. 有机物X中含C、H、O三种元素,其结构球棍模型如下图所示。下列说法正确的是( )
A、催化剂a表面形成N-H键时需吸收能量 B、使用催化剂a可以加快合成氨反应的正反应速率,减慢逆反应速率 C、反应时催化剂b表面有共价键的断裂和形成 D、催化剂b表面反应的化学方程式为:10. 工业合成氨是人类科学技术的一项重大突破。N2与H2反应合成氨为可逆反应,其热化学方程式为N2(g) + 3H2(g) = 2NH3(g) ΔH = − 92.4 kJ∙mol−1。氨气经氧化等步骤制得硝酸。利用石灰乳、尿素等吸收硝酸工业的尾气(含NO、NO2),石灰乳吸收时主要反应为NO + NO2 + Ca(OH)2 = Ca(NO2)2 + H2O。下列关于氮氧化物的形成、吸收等说法正确的是( )A、汽车尾气中含氮氧化物,主要来源于烃类燃料 B、用石灰乳吸收NO和NO2 , 增加气体流速可提高氮氧化物的吸收率 C、收集NO2气体时采用排水法,可提高NO2气体的纯度 D、用CO(NH2)2可将NO2转化为N2 , 是利用了CO(NH2)2的还原性11. 有机物X中含C、H、O三种元素,其结构球棍模型如下图所示。下列说法正确的是( ) A、X分子中含有1个氧原子 B、X分子中所有原子在同一平面上 C、向X的水溶液中滴入1~2滴酚酞溶液,溶液变红 D、X的水溶液可用于去除水瓶中的水垢12. O2在一定条件下能有效去除烟气中的SO2、NO,其可能的反应机理如下图所示,下列说法错误的是(HO•表示羟基自由基,•表示未成对电子) ( )
A、X分子中含有1个氧原子 B、X分子中所有原子在同一平面上 C、向X的水溶液中滴入1~2滴酚酞溶液,溶液变红 D、X的水溶液可用于去除水瓶中的水垢12. O2在一定条件下能有效去除烟气中的SO2、NO,其可能的反应机理如下图所示,下列说法错误的是(HO•表示羟基自由基,•表示未成对电子) ( ) A、O2转化为时失去电子 B、HO•中氧元素的化合价为-1 C、净化器内SO2被还原 D、净化器内NO发生的反应为3HO• + NO = HNO3 + H2O13. 在给定条件下,下列物质间所示的转化可以实现的是( )A、NO HNO3 B、CH3CH3CH2BrCH2Br C、Fe Fe(NO3)3 (aq) D、淀粉(aq) C6H12O6(葡萄糖)14. 实验室用FeSO4、(NH4)2SO4制备硫酸亚铁铵晶体[(NH4) m Fe(SO4) n·xH2O],(NH4) m Fe(SO4) n·xH2O和硫代乙酰胺溶液反应制取纳米硫化亚铁(FeS),反应流程如下:
A、O2转化为时失去电子 B、HO•中氧元素的化合价为-1 C、净化器内SO2被还原 D、净化器内NO发生的反应为3HO• + NO = HNO3 + H2O13. 在给定条件下,下列物质间所示的转化可以实现的是( )A、NO HNO3 B、CH3CH3CH2BrCH2Br C、Fe Fe(NO3)3 (aq) D、淀粉(aq) C6H12O6(葡萄糖)14. 实验室用FeSO4、(NH4)2SO4制备硫酸亚铁铵晶体[(NH4) m Fe(SO4) n·xH2O],(NH4) m Fe(SO4) n·xH2O和硫代乙酰胺溶液反应制取纳米硫化亚铁(FeS),反应流程如下:
下列有关说法错误的是( )
A、配制硫酸亚铁溶液时需加入一定量的铁粉,目的是防止Fe2+被氧化 B、n、m的等量关系式是2n-m = 2 C、“反应1”条件下,硫酸亚铁铵晶体的溶解度大于FeSO4与 (NH4)2SO4的 D、“反应2”需在一定pH条件下进行,酸性过强或碱性过强均不利于FeS的生成二、综合题
-
15. CO2还原为甲醇(CH3OH)是人工合成淀粉的第一步。CO2催化加氢主要反应为:CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH=-49.4 kJ·mol−1。(1)、H2O分子用电子式表示为。该反应中每生成0.5 mol甲醇,转移电子的物质的量是mol。(2)、一定条件下,该反应过程中的能量变化情况如图所示,图中E2-E1 =kJ·mol−1。
 (3)、T1℃下,向一容积为3 L的恒容密闭容器中加入一定量的CO2和H2 , 在催化剂存在时发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),测得不同时间(t)各物质的物质的量如下表:
(3)、T1℃下,向一容积为3 L的恒容密闭容器中加入一定量的CO2和H2 , 在催化剂存在时发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),测得不同时间(t)各物质的物质的量如下表:t / min
n(CO2) / mol
n(H2) / mol
n(CH3OH) / mol
n(H2O) / mol
0
2.00
6.00
0
0
t1
1.65
a
0.35
0.35
t2
b
3.60
0.80
0.80
t3
b
3.60
0.80
0.80
①0 ~ t1 min内,用H2浓度变化表示该反应的化学反应速率为mol·L−1·min−1。
②下列有关上述反应的说法正确的是(填序号)
A.CH3OH中的化学键是共价键
B.消耗3 mol H2(g)的同时生成1 mol H2O(g),此时该反应达到化学平衡
C.0 ~ t1 min内反应放出的热小于t1~ t2 min内放出的热
(4)、甲醇(CH3OH)燃料电池的电极采用膜电极,该电极由催化剂层和质子交换膜构成,其中质子交换膜能传导H+ , 同时作为隔膜防止两极的物质相互反应。该电池的工作原理如图:
①该电池的负极是。(填“电极a”或“电极b”)
②工作时,电极b的电极反应式是。
16. 化合物E是生产感光材料、功能色素和药物的中间体,其合成路线如下: (1)、化合物C中含氧官能团的名称为。(2)、A→B反应过程中除化合物B外,还有HCl生成。该反应的类型是。B→C反应过程中,化合物B表现出性(填“氧化”或“还原”)。(3)、C→D反应过程中有副产物Q(化学式为C7H4N2O6)生成,该化合物Q的结构简式是。D→E发生反应的化学方程式是。(4)、化合物B也可通过下列转化获取化合物C,请完成下列反应流程:。
(1)、化合物C中含氧官能团的名称为。(2)、A→B反应过程中除化合物B外,还有HCl生成。该反应的类型是。B→C反应过程中,化合物B表现出性(填“氧化”或“还原”)。(3)、C→D反应过程中有副产物Q(化学式为C7H4N2O6)生成,该化合物Q的结构简式是。D→E发生反应的化学方程式是。(4)、化合物B也可通过下列转化获取化合物C,请完成下列反应流程:。 17. 以FeSO4溶液为主要原料制取废水处理剂FeOOH,其流程如下:
17. 以FeSO4溶液为主要原料制取废水处理剂FeOOH,其流程如下: (1)、检验FeSO4溶液是否被氧化可选用的试剂是(填化学式)。“转化”时适量氨水将Fe2+部分转化为Fe(OH)2 , 每生成1 mol Fe(OH)2 , 理论上参加该反应的NH3·H2O的物质的量为mol。(2)、“氧化”时以一定流速向所得固液混合物中通入O2 , 反应生成FeOOH。过程中溶液的pH随时间的变化情况如图所示:
(1)、检验FeSO4溶液是否被氧化可选用的试剂是(填化学式)。“转化”时适量氨水将Fe2+部分转化为Fe(OH)2 , 每生成1 mol Fe(OH)2 , 理论上参加该反应的NH3·H2O的物质的量为mol。(2)、“氧化”时以一定流速向所得固液混合物中通入O2 , 反应生成FeOOH。过程中溶液的pH随时间的变化情况如图所示:
已知:pH =-lg c(H+) 。
①0~t1时,Fe(OH)2转化为FeOOH时发生反应的化学方程式为。
②t1~t2时,FeOOH继续增加,溶液pH减小,原因是(用离子方程式表示)。
(3)、通过下列方法测定产品中FeOOH的质量分数:准确称取2.000 g产品,加适量盐酸溶解,再加入适量SnCl2溶液,发生反应2Fe3+ + Sn2+ = 2Fe2+ + Sn4+;除去过量的SnCl2 , 再向其中加入0.1000 mol·L−1 K2Cr2O7溶液至反应恰好完全,发生反应Cr2O+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,消耗K2Cr2O7溶液36.00 mL。计算该产品中FeOOH的质量分数(写出计算过程) 。18. 氮的化合物是重要的化工原料,其转化一直是化学研究的热点。(1)、氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是(写化学式)。
③再经过一段时间观察到装置N中溶液变成蓝色,装置N中溶液变成蓝色的原因是。
(2)、可用ClO2将氮氧化物转化成NO。向1 L含200 mg ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2 , 再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为。(3)、纳米铁粉可去除水中的NO。控制其他条件不变,用纳米铁粉还原水体中的NO , 测得溶液中含氮物质(NO、NO、NH)浓度随时间变化如图所示: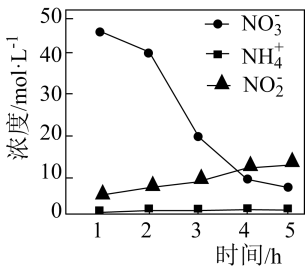
①Fe去除水中的NO 的机理:NO 得到纳米铁粉失去的电子转化为NO , 极少量NO 在纳米铁粉或Cu表面得到电子转化为NH。与不添加少量铜粉相比,添加少量铜粉时去除NO效率更高,主要原因是。
②与初始溶液中NO浓度相比,反应后溶液中所有含氮物质(NO、NO、NH)总浓度减小,原因是。