江苏省连云港市2021-2022学年高一下学期期末考试化学试题
试卷更新日期:2022-07-14 类型:期末考试
一、单选题
-
1. 青铜剑表面的蓝色薄锈主要成分为碱式碳酸铜,其生成反应为 。下列有关说法正确的是( )A、是还原剂 B、反应为化合反应 C、反应过程吸热 D、反应生成物是碱2. 乙烯可用于脱除烟气中并回收单质硫,发生的反应:。下列有关说法正确的是( )A、二氧化碳的电子式:
 B、乙烯的球棍模型:
B、乙烯的球棍模型: C、硫原子的结构示意图:
C、硫原子的结构示意图: D、水的结构式:
3. 铁及其化合物在生产、生活中应用广泛。下列有关它们的性质与用途具有对应关系的是( )A、有氧化性,可用作净水剂 B、有磁性,可用作高炉炼铁的原料 C、是红棕色,可用于制红色油漆 D、Fe有还原性,可用于铝热反应焊接钢轨4. 工业合成氨反应为 ;下列有关合成氨反应的说法正确的是( )A、1mol氮气和3mol氢气的总能量大于2mol氨气的总能量 B、当时,反应达到平衡状态 C、反应中每消耗转移电子的数目约等于 D、密闭容器中充入和充分反应放出热量5. 向饱和食盐水中通和析出 , 过滤后热分解得纯碱。下列关于与的说法错误的是( )A、的热稳定性大于 B、相同温度下,的溶解度小于的溶解度 C、可用于除去物品表面油污,可用于治疗胃酸过多 D、相同温度下,等物质的量浓度的的碱性大于的碱性6. 向饱和食盐水中通和析出 , 过滤后热分解得纯碱。实验室模拟工业制纯碱,能达到实验目的是( )
D、水的结构式:
3. 铁及其化合物在生产、生活中应用广泛。下列有关它们的性质与用途具有对应关系的是( )A、有氧化性,可用作净水剂 B、有磁性,可用作高炉炼铁的原料 C、是红棕色,可用于制红色油漆 D、Fe有还原性,可用于铝热反应焊接钢轨4. 工业合成氨反应为 ;下列有关合成氨反应的说法正确的是( )A、1mol氮气和3mol氢气的总能量大于2mol氨气的总能量 B、当时,反应达到平衡状态 C、反应中每消耗转移电子的数目约等于 D、密闭容器中充入和充分反应放出热量5. 向饱和食盐水中通和析出 , 过滤后热分解得纯碱。下列关于与的说法错误的是( )A、的热稳定性大于 B、相同温度下,的溶解度小于的溶解度 C、可用于除去物品表面油污,可用于治疗胃酸过多 D、相同温度下,等物质的量浓度的的碱性大于的碱性6. 向饱和食盐水中通和析出 , 过滤后热分解得纯碱。实验室模拟工业制纯碱,能达到实验目的是( ) A、用装置甲制取 B、用装置乙制取干燥氨气 C、用装置丙分离出固体 D、用装置丁分解制备7. 在题给条件下,下列选项所示的物质间转化能实现的是( )A、 B、C6H12O6(葡萄糖,aq)Ag(s) C、 D、8. 工业用溶液刻蚀电路板的废液中主要含有、、、 , 实验室从废液中回收某些物质的流程如下:
A、用装置甲制取 B、用装置乙制取干燥氨气 C、用装置丙分离出固体 D、用装置丁分解制备7. 在题给条件下,下列选项所示的物质间转化能实现的是( )A、 B、C6H12O6(葡萄糖,aq)Ag(s) C、 D、8. 工业用溶液刻蚀电路板的废液中主要含有、、、 , 实验室从废液中回收某些物质的流程如下: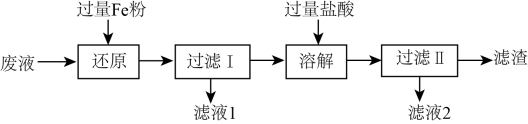
下列说法正确的是( )
A、还原过程中,溶液中可能存在的阳离子只有、、 B、溶解过程中反应的离子方程式: C、滤液1、滤液2合并后通入过量的重新获得溶液 D、滤渣的成分为Fe和Cu9. 暖贴内部含有铁粉、活性炭、食盐、木粉的混合物,可与空气氧气和水蒸气作用放热,从而达到取暖的效果,见题图。下列说法正确的是( ) A、暖贴工作时活性炭被消耗 B、暖贴工作时电能转化为化学能再转化为热能 C、铁作负极,其电极反应式: D、暖贴短时间产生较多的热是因为原电池的形成加快反应速率10. 柠檬酸常应用于食品工业,分子结构如图所示。下列有关柠檬酸的说法正确的是( )
A、暖贴工作时活性炭被消耗 B、暖贴工作时电能转化为化学能再转化为热能 C、铁作负极,其电极反应式: D、暖贴短时间产生较多的热是因为原电池的形成加快反应速率10. 柠檬酸常应用于食品工业,分子结构如图所示。下列有关柠檬酸的说法正确的是( ) A、柠檬酸能使溴水、酸性高锰酸钾溶液褪色 B、柠檬酸分子中含有羟基和酯基两种官能团 C、足量Na、分别与1mol柠檬酸反应,相同条件下生成气体体积比为2∶3 D、1mol柠檬酸在浓硫酸、加热条件下与足量的乙醇反应,消耗3mol乙醇11. 根据下列实验操作和现象所得到的结论正确的是( )A、碳酸钙与过量盐酸反应,某时间段内生成的速率先快后慢,速率加快的主要因素是温度升高 B、取溶液,向其中滴加溶液,取上层清液滴加KSCN溶液,溶液变成血红色,该反应是可逆反应 C、将红热的铂丝插入到盛有氨气和氧气的集气瓶,铂丝一直保持红热,集气瓶出现红棕色气体,氨气与氧气反应放热,无一氧化氮生成 D、分别向蛋白质溶液中加入饱和和溶液,均析出固体,蛋白质都发生变性12. 丙烯与氯化氢反应生成1—氯丙烷的能量随反应进程的变化如图所示,下列叙述正确的是( )
A、柠檬酸能使溴水、酸性高锰酸钾溶液褪色 B、柠檬酸分子中含有羟基和酯基两种官能团 C、足量Na、分别与1mol柠檬酸反应,相同条件下生成气体体积比为2∶3 D、1mol柠檬酸在浓硫酸、加热条件下与足量的乙醇反应,消耗3mol乙醇11. 根据下列实验操作和现象所得到的结论正确的是( )A、碳酸钙与过量盐酸反应,某时间段内生成的速率先快后慢,速率加快的主要因素是温度升高 B、取溶液,向其中滴加溶液,取上层清液滴加KSCN溶液,溶液变成血红色,该反应是可逆反应 C、将红热的铂丝插入到盛有氨气和氧气的集气瓶,铂丝一直保持红热,集气瓶出现红棕色气体,氨气与氧气反应放热,无一氧化氮生成 D、分别向蛋白质溶液中加入饱和和溶液,均析出固体,蛋白质都发生变性12. 丙烯与氯化氢反应生成1—氯丙烷的能量随反应进程的变化如图所示,下列叙述正确的是( ) A、该反应为取代反应 B、第I和II两步反应均放出能量 C、(E表示键能) D、1—氯丙烷同分异构体的结构简式为13. 探究乙酸乙酯在碱性条件下水解程度的实验如下:
A、该反应为取代反应 B、第I和II两步反应均放出能量 C、(E表示键能) D、1—氯丙烷同分异构体的结构简式为13. 探究乙酸乙酯在碱性条件下水解程度的实验如下:操作
结论
实验1
向试管中加入3mL饱和碳酸钠溶液、2mL乙酸乙酯、0.5mL水,充分振荡2min、静置
油层厚度不变
实验2
向试管中加入3mL饱和氢氧化钠溶液、2mL乙酸乙酯、0.5mL水,充分振荡2min、静置
有少量油滴
实验3
向试管中加入3mL饱和氢氧化钠溶液、2mL乙酸乙酯、0.5mL乙醇,充分振荡2min、静置
乳浊液变澄清,混合液温度迅速上升
下列说法错误的是( )
A、实验1中乙酸乙酯不水解是因为小及乙酸乙酯与水的接触面积小 B、实验1和实验2说明乙酸乙酯水解必须在较大的条件下才能进行 C、实验3说明乙醇的催化活性高,乙酸乙酯的水解反应为放热反应 D、以上实验得出结论:浓度越大,与乙酸乙酯接触面积越大,水解程度就越大14. 还原性纳米铁在碱性条件下易生成沉淀,在酸性条件下能将还原为。取2份含有一定浓度的水样加入纳米铁,并调节其中1份溶液的pH,溶液中的总氮去除率(加入纳米铁后溶液中N元素减少的质量÷加入纳米铁前溶液中N元素质量)与pH的关系如图1;在常温下调节另一份溶液的 , 测量溶液中含氮物质浓度随时间变化如图2。下列说法错误的是( ) A、pH过低溶液中总氮去除率低可能是纳米铁将溶液里还原为 B、pH过高溶液中总氮去除率低可能是纳米铁被沉淀包裹,还原性降低 C、溶液中总氮浓度下降,说明总氮去除率升高 D、时,纳米铁主要将还原为、
A、pH过低溶液中总氮去除率低可能是纳米铁将溶液里还原为 B、pH过高溶液中总氮去除率低可能是纳米铁被沉淀包裹,还原性降低 C、溶液中总氮浓度下降,说明总氮去除率升高 D、时,纳米铁主要将还原为、二、填空题
-
15. 氮的氧化物是主要的大气污染物,必须脱除才能排放。(1)、臭氧与空气中的氮氧化物和(填字母)在紫外线照射下产生光化学烟雾。
a.二氧化硫 b.碳氢化合物 c.二氧化碳
(2)、汽车排气管内的催化剂能将CO和转化为无害气体,发生的反应方程式为。(3)、工业上在催化剂作用下用还原废气中生成和达到脱除目的,但当温度高于400℃时,脱除率下降,原因可能是。(4)、工业上氮的氧化物通常是用碱性溶液吸收。①用溶液吸收硝酸工业尾气中的 , 生成等物质的量的两种钠盐(一种为)及一种气体,反应的离子方程式为。
②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如题图所示,曲线II表示NO的物质的量(填:“大于”、“小于”、“等于”)物质的量:当NaOH溶液浓度高于后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是。
 16. 放热反应在生产、生活中用途广泛。(1)、已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为。(2)、甲烷可以消除氮氧化物污染,发生的反应为 , 在体积固定的密闭容器中,每次实验均加入和 , 使、 , 在不同条件下进行反应,测得随时间的变化情况如下表:
16. 放热反应在生产、生活中用途广泛。(1)、已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为。(2)、甲烷可以消除氮氧化物污染,发生的反应为 , 在体积固定的密闭容器中,每次实验均加入和 , 使、 , 在不同条件下进行反应,测得随时间的变化情况如下表:实验
序号
时间/min
浓度
温度/℃
10
20
30
40
50
1
800
0.80
0.67
0.57
0.50
0.50
2
800
0.60
0.50
0.50
0.50
0.50
①实验1中,在10~20min内, , 40min时v(正)v(逆)(填:“大于”、“小于”、“等于”)。
②0~20min内,实验2比实验1反应速率快的原因可能是。
(3)、乙醇应用于燃料电池,该电池采用可传导的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为。 (4)、乙醇在Cu作催化剂时与氧气反应的关系如图2,反应②的化学方程式:。
(4)、乙醇在Cu作催化剂时与氧气反应的关系如图2,反应②的化学方程式:。 (5)、硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。高温分解不可能生成。理由是。
(5)、硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。高温分解不可能生成。理由是。三、综合题
-
17. 由苯乙炔合成某些有机物的路线如下:
 (1)、化合物G的结构简式。(2)、反应①→④中属于取代反应的是。(3)、写出反应⑤的化学方程式。(4)、写出符合下列条件的化合物
(1)、化合物G的结构简式。(2)、反应①→④中属于取代反应的是。(3)、写出反应⑤的化学方程式。(4)、写出符合下列条件的化合物 同分异构体的结构简式:。
同分异构体的结构简式:。①苯环上只有一个取代基
②能与反应
(5)、请完成以乙炔为原料制备 的合成路线流程图(有机物用结构简式表示)。
的合成路线流程图(有机物用结构简式表示)。 18. 实验室利用如图装置制备和。
18. 实验室利用如图装置制备和。 (1)、仪器a的名称。(2)、装置A中发生反应的化学方程式为。(3)、装置B的作用是吸收 , 发生反应的离子方程式为;请设计实验证明反应完成后装置B的溶液中既有又有:(可选用的试剂:双氧水、硫氰化钾溶液、酸性高锰酸钾溶液)。(4)、向装置B中加适量的NaOH溶液,经过滤、洗涤、灼烧制得样品,为测定该(含有FeO)样品的纯度,进行的实验步骤如下:
(1)、仪器a的名称。(2)、装置A中发生反应的化学方程式为。(3)、装置B的作用是吸收 , 发生反应的离子方程式为;请设计实验证明反应完成后装置B的溶液中既有又有:(可选用的试剂:双氧水、硫氰化钾溶液、酸性高锰酸钾溶液)。(4)、向装置B中加适量的NaOH溶液,经过滤、洗涤、灼烧制得样品,为测定该(含有FeO)样品的纯度,进行的实验步骤如下:步骤1:称取一定量样品置于锥形瓶中,加入足量稀硫酸,加热使之完全溶解。
步骤2:向锥形瓶中滴加溶液,发生反应: , 恰好完全反应时,共消耗溶液。
步骤3:将步骤2得到溶液配制成1000mL溶液,取该溶液1.00mL,稀释至25.6L,测得溶液的吸光度为0.7618.已知:吸光度与溶液中铁离子含量(c)的标准曲线如图。

计算样品中的物质的量(写出计算过程)。