高中化学人教版(2019)必修第一册第三章第一节 铁及其化合物
试卷更新日期:2022-07-14 类型:同步测试
一、单选题
-
1. 把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )A、稀硫酸 B、Fe2(SO4)3溶液 C、CuSO4溶液 D、AgNO3溶液2. 下列关于铁及其化合物的说法正确的是( )A、红热的铁能与水蒸气反应,生成和 B、在空气中充分灼烧得到FeO C、FeO是一种黑色粉末,不稳定,在空气中受热,迅速转化成红棕色粉末 D、过量铁与氯气或者稀盐酸反应均可制得3. 下列有关物质性质和用途说法正确的是( )A、将钠粒投入到硫酸铜溶液中,可析出单质铜 B、将碳酸钠固体加入到氯水中,不能产生二氧化碳气体 C、常温下,铁与氯气不反应,故可以用钢瓶储运氯气 D、有单质参加的反应一定是氧化还原反应4. 向含有一定物质的量的和的混合溶液中逐渐加入粉至过量,该溶液的质量随加入铁粉的质量的变化关系图为( )A、
 B、
B、 C、
C、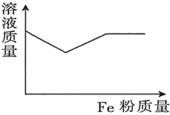 D、
D、 5. 下列有关铁及其化合物的说法中,错误的是( )
5. 下列有关铁及其化合物的说法中,错误的是( ) A、如图所示操作可制取 B、红热的铁与水蒸气发生反应,生成红棕色的固体 C、均可以由化合反应制得 D、胶体可用饱和氯化铁溶液和沸水制备6. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A、如图所示操作可制取 B、红热的铁与水蒸气发生反应,生成红棕色的固体 C、均可以由化合反应制得 D、胶体可用饱和氯化铁溶液和沸水制备6. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、a可与e反应生成b B、a与盐酸反应可生成e C、b既可被氧化,也可被还原 D、c是白色沉淀,可转化为红褐色沉淀d7. 元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是( )
A、a可与e反应生成b B、a与盐酸反应可生成e C、b既可被氧化,也可被还原 D、c是白色沉淀,可转化为红褐色沉淀d7. 元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是( ) A、铁与氧气的燃烧反应可实现上述①转化 B、加热Fe(OH)3发生转化⑥,Fe2O3 加水溶解可转化为Fe(OH)3 C、由图可预测:高铁酸盐()具有强氧化性,可用于饮用水的消毒 D、FeO是种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe2O38. 下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol/L硫酸溶液、NaOH溶液。下列说法不正确的是( )
A、铁与氧气的燃烧反应可实现上述①转化 B、加热Fe(OH)3发生转化⑥,Fe2O3 加水溶解可转化为Fe(OH)3 C、由图可预测:高铁酸盐()具有强氧化性,可用于饮用水的消毒 D、FeO是种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe2O38. 下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol/L硫酸溶液、NaOH溶液。下列说法不正确的是( ) A、B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 B、实验开始时应先将活塞E关闭 C、生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 D、取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)39. 下列实验操作能达到相应目的的是( )
A、B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 B、实验开始时应先将活塞E关闭 C、生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 D、取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)39. 下列实验操作能达到相应目的的是( )选项
A
B
C
D
实验操作




目的
证明该装置气密性良好
观察Fe(OH)2的生成
干燥Cl2
除去Cl2中的少量HCl
A、A B、B C、C D、D10. 将某难溶于水的含铁化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量的氯水,溶液立即呈红色,该化合物是( )A、Fe2O3 B、FeCl3 C、FeSO4 D、FeO11. 三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列符合要求的组合是( ) A、①② B、①③ C、②③ D、①②③12. 下列有关铁的氧化物的说法中,错误的是( )A、赤铁矿主要成分是Fe2O3 , Fe2O3是红棕色的,常用作红色油漆和涂料 B、Fe3O4是黑色晶体,其中 的铁显+2价, 的铁显+3价 C、FeO、Fe2O3、Fe3O4都不溶于水,但都能和盐酸反应生成相应的盐 D、FeO不稳定,在空气中加热迅速被氧化成Fe2O313. “磁性胶体粒子”是磁盘、录影带常用的材料,利用表面有少量红锈斑的废铁屑制备磁性四氧化三铁胶体的简单流程如下,下列说法正确的是( )
A、①② B、①③ C、②③ D、①②③12. 下列有关铁的氧化物的说法中,错误的是( )A、赤铁矿主要成分是Fe2O3 , Fe2O3是红棕色的,常用作红色油漆和涂料 B、Fe3O4是黑色晶体,其中 的铁显+2价, 的铁显+3价 C、FeO、Fe2O3、Fe3O4都不溶于水,但都能和盐酸反应生成相应的盐 D、FeO不稳定,在空气中加热迅速被氧化成Fe2O313. “磁性胶体粒子”是磁盘、录影带常用的材料,利用表面有少量红锈斑的废铁屑制备磁性四氧化三铁胶体的简单流程如下,下列说法正确的是( ) A、废铁屑与硫酸反应过程中涉及的氧化还原反应只有一个 B、加适量的目的是将部分氧化为 C、溶液A中和的浓度最佳比为 D、提纯胶体的方法是过滤14. 下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
A、废铁屑与硫酸反应过程中涉及的氧化还原反应只有一个 B、加适量的目的是将部分氧化为 C、溶液A中和的浓度最佳比为 D、提纯胶体的方法是过滤14. 下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
A、②③①④ B、③②①④ C、③①②④ D、①②③④15. 纳米级四氧化三铁是应用最为广泛的软磁性材料之一、共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图所示:
下列说法不正确的是( )
A、保存溶液A时,应加入少量铁粉 B、FeSO4•7H2O和FeCl3•6H2O的物质的量之比最好应为2∶1 C、取滤液进行焰色反应,火焰为黄色 D、其制备反应类型不属于氧化还原反应16. 将1.12 g铁粉加入25mL2mol⋅L-1氯化铁溶液中充分反应(忽略溶液体积变化),下列分析正确的是( )A、铁粉有剩余 B、Cl-浓度减小 C、向溶液中滴入无色KSCN溶液,溶液不变红 D、反应液质量增加1.12 g17. 工业上可利用FeCl3溶液腐蚀铜箔的原理制造印刷线路板。将一块铜箔放入500mL1.0mol/L的FeCl3溶液中,经过一段时间后制成了印刷线路板。下列与此有关的叙述正确的是( )A、Cu是还原剂,FeCl3是氧化剂 B、腐蚀液中Cl-的浓度明显减小 C、腐蚀液的氧化性增强 D、转移的电子一定是0.50mol18. 把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中浓度是浓度的倍,则已反应的和未反应的的物质的量之比为( )A、:1 B、:2 C、:3 D、:419. 为检验溶液里的某种离子,进行下列实验,其中结论正确的是( )A、溶液中加 AgNO3 溶液有白色沉淀生成,再加入稀盐酸沉淀不溶解,溶液一定含 Cl- B、先滴加 KSCN 溶液不显红色,再滴加氯水后显红色证明某溶液中含有 Fe2- C、某溶液进行焰色反应为黄色,则该溶液一定含有 Na+ ,一定没有K+ D、溶液中加入稀 HCl,产生使澄清石灰水变浑浊的无色气体,则溶液中一定含 CO32-20. 下列能证明某溶液中只含Fe2+而不含Fe3+的实验方法是( )A、只滴加KSCN溶液 B、滴加NaOH溶液,产生白色沉淀 C、先滴加氯水,再滴加KSCN溶液后显红色 D、先滴加KSCN溶液,不显红色,再滴加氯水后显红色二、推断题
-
21. A~H分别表示中学化学中常见的某种物质,它们之间的相互转化关系如图所示(部分反应物、生成物未列出)。已知:C、D、E、F、G五种物质中均含有同一种元素;A为淡黄色固体化合物;G为红褐色固体。
 (1)、请写出C的化学式。(2)、在D溶液中滴加H溶液,描述发生的现象:。(3)、写出①的化学方程式。写出⑥的化学方程式。22. 已知、、、均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)。请回答下列问题:
(1)、请写出C的化学式。(2)、在D溶液中滴加H溶液,描述发生的现象:。(3)、写出①的化学方程式。写出⑥的化学方程式。22. 已知、、、均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)。请回答下列问题: (1)、若为常见的非金属单质,常温下为固体,、、均为气体。与的反应需要在高温下进行,则二者反应的化学方程式为。(2)、若、、的溶液均显碱性,常用于培制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂,则的俗名为 , 与反应生成的离子方程式为。(3)、若为用量最大、用途最广泛的金属单质。它的一种氧化物为红棕色固体,可用作颜料。是一种黄绿色气体,则的化学式为 , 与Cu反应的离子方程式为 , 与反应生成B的化学反应方程式为。
(1)、若为常见的非金属单质,常温下为固体,、、均为气体。与的反应需要在高温下进行,则二者反应的化学方程式为。(2)、若、、的溶液均显碱性,常用于培制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂,则的俗名为 , 与反应生成的离子方程式为。(3)、若为用量最大、用途最广泛的金属单质。它的一种氧化物为红棕色固体,可用作颜料。是一种黄绿色气体,则的化学式为 , 与Cu反应的离子方程式为 , 与反应生成B的化学反应方程式为。三、实验探究题
-
23. 高温下普通铁粉和水蒸气反应生成四氧化三铁,四氧化三铁被氢气还原生成颗粒很细、活性很高的铁粉,俗称“引火铁”。现用普通铁粉、稀盐酸、金属锌和水等试剂制备“引火铁”,装置如下:

请填写下列空白:
(1)、由四氧化三铁制取“引火铁”选用装置。(填“图1”或“图2”)(2)、为了安全,在试管E中的反应发生前,导管F出口处的气体必须。(3)、试管A中发生反应的化学方程式。(4)、实验中需要加热的仪器有(填该仪器对应的字母)(5)、烧瓶C的作用;实验时,U形管G中应加入的试剂。24. 铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ. KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。
 (1)、将补铁剂碾碎的目的是。(2)、试剂1是 , 试剂2是。(3)、加入试剂2后溶液变为浅红色,说明溶液①中含有。(4)、能证明溶液①中含有Fe2+的实验现象是。(5)、补全在上述条件下Fe2+与H2O2发生反应的离子方程式:
(1)、将补铁剂碾碎的目的是。(2)、试剂1是 , 试剂2是。(3)、加入试剂2后溶液变为浅红色,说明溶液①中含有。(4)、能证明溶液①中含有Fe2+的实验现象是。(5)、补全在上述条件下Fe2+与H2O2发生反应的离子方程式:H+ + Fe2+ + H2O2 = _+ _
(6)、甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。a.甲同学猜测的依据是。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是。
(7)、计算每片该补铁剂含铁元素的质量为 g。(8)、人体只能吸收Fe2+ , 医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是。25. 铁常见的化合价有0、+2、+3,某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物,请回答下列问题: (1)、A中碎瓷片的作用是。(2)、E中黑色固体变成红色,则B中生成的气体是。(3)、A、B两个装置中应先点燃 处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是。(4)、实验小组同学对反应后B装置玻璃管内的剩余固体进行探究
(1)、A中碎瓷片的作用是。(2)、E中黑色固体变成红色,则B中生成的气体是。(3)、A、B两个装置中应先点燃 处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是。(4)、实验小组同学对反应后B装置玻璃管内的剩余固体进行探究①甲同学发现固体仍为黑色,由此判断:固体中肯定不存在Fe2O3 , 理由是。
②乙同学发现固体能全部被磁铁吸引,即做出了猜想:
猜想I:全是Fe;
猜想II:全是Fe3O4;
猜想III:;
实验小组同学准确称取10g固体于试管中进行实验,加入过量溶液,出现红色固体,且有黑色固体残留,猜想成立。将上述实验后试管内的剩余物过滤、洗涤、干燥,称得固体质量为10.4g,则铁与水蒸气反应后玻璃管内固体中Fe3O4的质量分数为。