上海市金山区2021-2022学年高三下学期质量监考(二模)化学试题
试卷更新日期:2022-07-13 类型:高考模拟
一、单选题
-
1. 下列熔点最高的轻金属是( )A、Na B、Mg C、Al D、Fe2. 同温同压下,等质量的CO、CO2气体,下列物理量中CO<CO2的是( )A、分子数 B、体积 C、摩尔体积 D、密度3. 液氨中存在:2NH3(l) NH+NH。下列有关化学用语表示正确的是( )A、NH3的比例模型:
 B、NH的空间构型:三角锥形
C、NH的电子式:
B、NH的空间构型:三角锥形
C、NH的电子式: D、平衡常数表达式:
4. 34Se与S为同主族元素。有关性质的比较错误的是( )A、半径:Se>S B、沸点:H2O>H2Se C、酸性:H2SeO4>H2SO4 D、非金属性:Cl>Se5. 在给定条件下,下列物质间的转化不能实现的是( )A、FeFeCl3 B、FeFeSO4 C、FeFe3O4 D、FeFeCl26. NaI晶体中两核间距约0.28 nm,呈共价键;激光脉冲照射NaI时,Na+和I—两核间距为1.0~1.5 nm,呈离子键。下列说法正确的是( )A、离子化合物中不可能含共价键 B、共价键和离子键之间没有明显界线 C、NaI晶体中既有离子键又有共价键 D、NaI晶体是离子化合物和共价化合物的混合物7. 下列关于化合物a(
D、平衡常数表达式:
4. 34Se与S为同主族元素。有关性质的比较错误的是( )A、半径:Se>S B、沸点:H2O>H2Se C、酸性:H2SeO4>H2SO4 D、非金属性:Cl>Se5. 在给定条件下,下列物质间的转化不能实现的是( )A、FeFeCl3 B、FeFeSO4 C、FeFe3O4 D、FeFeCl26. NaI晶体中两核间距约0.28 nm,呈共价键;激光脉冲照射NaI时,Na+和I—两核间距为1.0~1.5 nm,呈离子键。下列说法正确的是( )A、离子化合物中不可能含共价键 B、共价键和离子键之间没有明显界线 C、NaI晶体中既有离子键又有共价键 D、NaI晶体是离子化合物和共价化合物的混合物7. 下列关于化合物a( )和b(
)和b( )的说法正确的是( ) A、a中所有原子共平面 B、a的二氯代物有6种 C、a、b的分子式均为C6H8 D、a、b均可使KMnO4/H+(aq)褪色8. 下列有关实验室制取Cl2的装置正确的是( )A、制备Cl2
)的说法正确的是( ) A、a中所有原子共平面 B、a的二氯代物有6种 C、a、b的分子式均为C6H8 D、a、b均可使KMnO4/H+(aq)褪色8. 下列有关实验室制取Cl2的装置正确的是( )A、制备Cl2 B、净化Cl2
B、净化Cl2 C、收集Cl2
C、收集Cl2 D、尾气处理
D、尾气处理 9. N2H4作火箭燃料的原理:2N2H4+2NO2→3N2+4H2O。有关说法正确的是( )A、22.4 L(STP)H2O中有质子10 NA B、1 mol N2H4中共用电子对6 NA C、反应生成3 mol N2 , 转移电子8 NA D、2 mol NO与足量O2反应得到NO2分子2 NA10. 由X、Y转化为M的反应历程如图所示,下列说法错误的是( )
9. N2H4作火箭燃料的原理:2N2H4+2NO2→3N2+4H2O。有关说法正确的是( )A、22.4 L(STP)H2O中有质子10 NA B、1 mol N2H4中共用电子对6 NA C、反应生成3 mol N2 , 转移电子8 NA D、2 mol NO与足量O2反应得到NO2分子2 NA10. 由X、Y转化为M的反应历程如图所示,下列说法错误的是( ) A、①→②的总过程放热 B、M是CH3COOH C、反应过程中形成C-H键 D、反应X+Y→M的原子利用率为100%11. 常温下,酸性:H2C2O4>HC2O>H2CO3>HCO。下列离子方程式正确的是( )A、H2C2O4+CO→HCO+HC2O B、H2C2O4+CO→H2O+CO2↑+C2O C、H2O+CO2+2C2O→2HC2O+CO D、H2O+CO2+C2O→HCO+HC2O12. 如图是我国化学家合成的聚乙炔衍生物的结构简式(M),下列说法正确的是( )
A、①→②的总过程放热 B、M是CH3COOH C、反应过程中形成C-H键 D、反应X+Y→M的原子利用率为100%11. 常温下,酸性:H2C2O4>HC2O>H2CO3>HCO。下列离子方程式正确的是( )A、H2C2O4+CO→HCO+HC2O B、H2C2O4+CO→H2O+CO2↑+C2O C、H2O+CO2+2C2O→2HC2O+CO D、H2O+CO2+C2O→HCO+HC2O12. 如图是我国化学家合成的聚乙炔衍生物的结构简式(M),下列说法正确的是( ) A、M为纯净物 B、M能发生加成、氧化和还原反应 C、1 mol M在足量NaOH溶液中完全水解消耗n mol NaOH D、合成M的单体有
A、M为纯净物 B、M能发生加成、氧化和还原反应 C、1 mol M在足量NaOH溶液中完全水解消耗n mol NaOH D、合成M的单体有 和CH3CH2OOCCH(OH)CH3
13. 自然界中氮的部分循环过程如图,有关说法正确的是( )
和CH3CH2OOCCH(OH)CH3
13. 自然界中氮的部分循环过程如图,有关说法正确的是( ) A、过程①和②均属于自然固氮 B、X→Y发生化合反应 C、NH3→N发生氧化还原反应 D、若为硫循环,X在空气中点燃可得Y14. 工业上通过惰性电极电解Na2SO4浓溶液来制备NaOH和H2SO4 , a、b为离子交换膜,装置如图所示。下列说法正确的是( )
A、过程①和②均属于自然固氮 B、X→Y发生化合反应 C、NH3→N发生氧化还原反应 D、若为硫循环,X在空气中点燃可得Y14. 工业上通过惰性电极电解Na2SO4浓溶液来制备NaOH和H2SO4 , a、b为离子交换膜,装置如图所示。下列说法正确的是( ) A、c电极与电源负极相连 B、从d口得到H2SO4(aq) C、若生成1 mol O2 , 有2 mol Na+穿过a D、电解总反应:2Na2SO4+6H2O2H2SO4+4NaOH+O2↑+2H2↑15. 除去下列物质中的杂质,所选试剂与分离方法均能达到目的的是( )
A、c电极与电源负极相连 B、从d口得到H2SO4(aq) C、若生成1 mol O2 , 有2 mol Na+穿过a D、电解总反应:2Na2SO4+6H2O2H2SO4+4NaOH+O2↑+2H2↑15. 除去下列物质中的杂质,所选试剂与分离方法均能达到目的的是( )物质(杂质)
除杂试剂
分离方法
A
NaCl(aq)(I2)
CCl4
分液
B
C2H5OH(CH3COOH)
NaOH(aq)
蒸馏
C
HCl(Cl2)
饱和食盐水
洗气
D
CaSO4(CaCO3)
稀硫酸
过滤
A、A B、B C、C D、D16. 由于氯化铵的市场价格过低,某制碱厂在侯氏制碱基础上改进的工艺如图:
有关该制碱工艺描述错误的是( )
A、原料是饱和NaCl(aq)、CO2 B、NH3循环使用 C、X可能是石灰乳 D、产品是Na2CO3和CaCl217. 常温下,等体积等浓度的盐酸与下列溶液分别恰好完全中和。①V1 mL pH=9的氨水;②V2 mL pH=10的氨水
下列判断正确的是( )
A、10V2>V1 B、的比值:②>① C、水的电离程度:②>① D、反应后溶液的pH:①>②18. 某溶液含Na+、NH、SO、Cl-、Fe2+、Fe3+中的几种,且各离子浓度相同。为确定其组成,进行实验:①取少量溶液,加入足量HNO3酸化的Ba(NO3)2(aq),产生白色沉淀,过滤;②向滤液中加入足量的NaOH(aq),产生红褐色沉淀,微热,产生气体。关于原溶液的说法正确的是( )
A、不能确定是否有Fe3+ B、需通过焰色反应确定Na+是否存在 C、Fe2+、Fe3+都存在 D、存在NH、SO、Cl-、Fe2+19. 一定温度下,在3个体积均为的恒容密闭容器中发生反应 , 相关数据如下表(已知:炭粉足量)。容器
T/℃
物质的起始浓度/()
物质的平衡浓度 ()
Ⅰ
1.00
0
0
0.85
Ⅱ
0
1.00
1.00
x
Ⅲ
2.00
0
0
1.60
下列说法错误的是( )
A、 B、达到平衡所需时间: C、 D、℃,该反应的化学平衡常数20. 常温下,用0.100 mol·L-1 NaOH(aq)滴定20.00 mL c mol·L-1二元酸H2A,滴定曲线如图所示,下列叙述正确的是( ) A、H2A电离:H2A→2H++A2- B、a点:c(HA-)>c(Na+)>c(H+)>c(A2-)>c(OH-) C、b点:c(H+)=c(A2-)+c(OH-) D、c点:c(Na+)<c(HA-)+2c(A2-)
A、H2A电离:H2A→2H++A2- B、a点:c(HA-)>c(Na+)>c(H+)>c(A2-)>c(OH-) C、b点:c(H+)=c(A2-)+c(OH-) D、c点:c(Na+)<c(HA-)+2c(A2-)二、非选择题
-
21. 氢是宇宙中最丰富的元素,H2有多种制法。完成下列填空:(1)、氢原子的核外电子排布轨道表示式是。三种含氢微粒:H、H+、H-的半径由大到小依次为。(2)、充填气象观测气球时,可用CaH2与H2O反应制H2 , 反应的化学方程式为。从物质结构角度解释熔点:CaH2>BaH2的原因(3)、实验室用含杂质的锌粒与稀H2SO4反应制得的H2中,含杂质PH3、AsH3和H2S,杂质气体的热稳定性由强到弱依次为 , PH3的空间构型是。(4)、水直接热解条件苛刻,人们设计了Ca-Fe-Br循环制H2。涉及反应:
FeBr2(s)+H2O(g)
 Fe3O4(s)+HBr(g)+H2(g)
Fe3O4(s)+HBr(g)+H2(g)配平上述化学方程式并标出电子转移的方向和数目。
22. S8在300℃左右会分解成S2 , 过程中吸收热量;烟气中的SO2可催化还原成硫蒸气,主要涉及以下反应:①2SO2(g)+CH4(g) S8(g)+CO2(g)+2H2O(g)+Q1(Q1>0)
②2SO2(g)+CH4(g) S2(g)+CO2(g)+2H2O(g)+Q2(Q2>0)
在容积固定的2 L密闭容器中,通入2 mol SO2和1 mol CH4 , 一定条件下发生上述反应。完成下列填空:
(1)、Q1Q2(选填“>”或“<”)。能说明反应已达平衡状态的是。(选填编号)A.CO2物质的量浓度不变 B.气体密度不变
C.容器内压强不变 D.容器内SO2与CH4的物质的量之比不变
(2)、如图为相同时间内测得SO2的转化率随温度变化情况。
a点是否已达到化学平衡状态?(选填“是”或“否”)。随着温度升高,SO2转化率先升后降的原因是。
(3)、如图为某温度时,SO2和CH4的物质的量随时间变化情况。
0~2 h内,v(CH4)=。温度不变,若要提高SO2的平衡转化率可采取的措施是(任写一条)。
(4)、烟气中的SO2常用氨水吸收。向氨水中通入SO2 , 测得溶液的pH与各含硫组分物质的量分数的关系如图所示。溶液的pH=7时,n(SO)∶n(HSO)≈。氨水吸收烟气中SO2后,经O2催化氧化可得到硫酸盐。控制合适的温度,随着氧化的进行,溶液的pH(选填“增大” 或“减小”)。 23. 丙酮(
23. 丙酮( )是常见的有机化工基础原料,以下是以丙酮为原料合成G(
)是常见的有机化工基础原料,以下是以丙酮为原料合成G(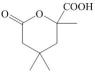 )的路线:
)的路线:
完成下列填空:
(1)、G中含有的官能团的名称是、;A→B的反应类型是。(2)、写出检验B中是否混有A的实验方法。(3)、写出C→D的第一步反应的化学方程式。(4)、D→E反应所需试剂和条件是 , 写出满足下列条件的D的一种同分异构体的结构简式。(i)分子中只有2种不同化学环境的氢;(ii)能发生银镜反应
(5)、参照上述合成路线所给信息,将一条以HCHO、CH2=CH2为有机原料(无机试剂任选)合成 的流程补充完整。
的流程补充完整。 24. CuCl(M=99.5 g·mol-1 )是有机合成常用催化剂,不溶于醇,湿的CuCl在空气中易水解,也会被O2氧化为Cu2(OH)3Cl。工业上有多种途径合成CuCl:
24. CuCl(M=99.5 g·mol-1 )是有机合成常用催化剂,不溶于醇,湿的CuCl在空气中易水解,也会被O2氧化为Cu2(OH)3Cl。工业上有多种途径合成CuCl:
完成下列填空:
(1)、步骤①控制反应温度在70~80℃的方法是。步骤①②都必须外加NaCl(s)至接近饱和的原因是。(2)、已知:Cu2++Cu+2Cl-→2CuCl↓。途径二使用中间步骤生成NaCuCl2 , 而不用一步法直接制取CuCl的原因是。(3)、步骤③的操作是加水稀释后过滤,过滤所用玻璃仪器有烧杯、、。(4)、步骤④洗涤CuCl粗品时,需经稀盐酸洗、醇洗。稀盐酸洗涤的目的是 , “醇洗”可快速除去CuCl粗品表面的水,防止CuCl被氧化,写出CuCl被氧化的化学方程式。(5)、称取0.500 g CuCl成品置于过量FeCl3(aq)中,待固体完全溶解后,用0.2000 mol·L-1的Ce(SO4)2标准液滴定至终点,消耗Ce(SO4)2标准液24.60 mL。相关反应如下:Fe3++CuCl→Fe2++Cu2++Cl-;Ce4++Fe2+→Fe3++Ce3+。则CuCl的质量分数是(小数点后保留三位数字),若滴定操作耗时过长可能会使测定的CuCl质量分数(选填“偏高”或“偏低”)。