贵州省遵义市2022届高三下学期三模理科综合化学试题
试卷更新日期:2022-07-13 类型:高考模拟
一、单选题
-
1. 化学与生产、生活密切相关,下列物质的性质、用途都正确且有相关性的是( )
选项
性质
用途
A
CCl4难溶于水,难于燃烧
CCl4常用作有机溶剂和灭火剂
B
Al2O3既能与强酸反应,又能与强碱反应
Al2O3常用作耐高温材料
C
SiO2透明,折射率合适,能够发生全反射
SiO2用作光导纤维材料
D
Cl2具有漂白性
常用Cl2对自来水进行杀菌消毒
A、A B、B C、C D、D2. 下列有关有机物的说法中,正确的是( )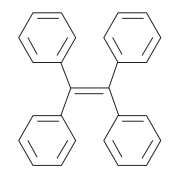 A、聚乙烯(
A、聚乙烯( )是纯净物
B、四苯乙烯(如上图)中所有原子不可能共面
C、我国科学家用CO2合成了淀粉,此淀粉是天然高分子化合物
D、C4H10O有7种同分异构体
3. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、0.1molI2与1molH2反应,生成HI分子数为0.2NA B、25℃时,1L0.2mol/LCH3COONH4溶液(pH=7)中,数为0.2NA C、标准状况下,11.2L苯中,含有0.5NA个苯分子 D、20gCa2+含有的电子数为9NA4. 已知常温时,0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )A、加水稀释H2A溶液,H2A的电离程度增大,溶液中各离子浓度均减小 B、在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)>c(HA-) C、在Na2A、NaHA两溶液中,离子种类不相同 D、在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)5. 化学是一门以实验为基础的学科。下列所选试剂(或操作)和实验装置合理的是( )
)是纯净物
B、四苯乙烯(如上图)中所有原子不可能共面
C、我国科学家用CO2合成了淀粉,此淀粉是天然高分子化合物
D、C4H10O有7种同分异构体
3. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、0.1molI2与1molH2反应,生成HI分子数为0.2NA B、25℃时,1L0.2mol/LCH3COONH4溶液(pH=7)中,数为0.2NA C、标准状况下,11.2L苯中,含有0.5NA个苯分子 D、20gCa2+含有的电子数为9NA4. 已知常温时,0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )A、加水稀释H2A溶液,H2A的电离程度增大,溶液中各离子浓度均减小 B、在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)>c(HA-) C、在Na2A、NaHA两溶液中,离子种类不相同 D、在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)5. 化学是一门以实验为基础的学科。下列所选试剂(或操作)和实验装置合理的是( )
选项
实验目的
选用试剂(或操作)
实验装置
A
验证Fe2+和Br-的还原性强弱
取适量FeBr2溶液,通入少量Cl2(不能与任何微粒完全反应),一段时间后,将溶液放入CCl4中摇匀、静置
甲
B
制备氢氧化亚铁
取新制FeSO4溶液,滴加NaOH溶液
乙
C
除去CO2中少量的SO2、H2O(g)
试剂a为饱和碳酸钠溶液
丙
D
制备AlCl3固体
蒸发AlCl3饱和溶液
丁
A、A B、B C、C D、D6. a、b、c、d是原子序数依次增大的短周期元素,甲、乙、丙、丁、戊、己是由这四种元素组成的单质或化合物。它们之间有如下反应:①甲+乙→戊+己;②甲+丙→丁+己。已知己是由c元素形成的常见单质,常温时,0.01mol/L戊溶液的pH=12。下列说法中错误的是( )A、b是第二周期元素 B、甲中有非极性共价键,且1mol甲中含有4mol离子 C、己在自然界中有同素异形体 D、c、d形成的简单离子,它们的电子层结构相同7. 利用电化学原理,模拟工业电解法来处理含的废水。如下图所示;电解过程中溶液发生反应:+6Fe2++14H+=2Cr3++6Fe3++7H2O。下列说法中错误的是( ) A、石墨I极是负极 B、当电路中有3mol电子转移时,Fe(I)极上有56g铁参与反应 C、在反应前后甲装置中的数目不变 D、石墨II极上的反应是:2N2O5+O2+4e-=4
A、石墨I极是负极 B、当电路中有3mol电子转移时,Fe(I)极上有56g铁参与反应 C、在反应前后甲装置中的数目不变 D、石墨II极上的反应是:2N2O5+O2+4e-=4二、非选择题
-
8. 溴苯是一种重要的化工原料,可用作溶剂、汽车燃料、有机合成原料、合成医药农药、染料等。纯净的溴苯是一种无色透明的油状液体。其制备原理如下:
 +Br2
+Br2 +HB。
+HB。实验操作:先将铁粉和苯加入反应器a(如图所示)中,在搅拌下缓慢加入液溴,于70-80℃保温反应数小时,得棕褐色液体。将棕褐色液体转移到分液漏斗中,依次用水洗、5%氢氧化钠溶液洗、水洗、干燥。过滤,最后经常压分馏,收集155-157℃馏分。相关物质有关数据如下:
苯
溴
溴苯
密度:g/cm-3
0.88
3.10
1.50
沸点/℃
80
59
156
水中的溶解度
微溶
微溶
微溶

请回答下列问题:
(1)、b装置的名称为 , 该装置还缺少一个装置。(2)、c装置的作用是。(3)、提纯过程中,NaOH的作用是(用离子方程式表示)。第二次水洗的主要目的是。(4)、最后仍要分馏的目的是。(5)、a中发生的无机反应化学方程式是。(6)、锥形瓶中盛有AgNO3溶液,其现象是。(7)、本次实验取用110mL苯,溴足量,在制粗溴苯的过程中,苯的利用率是84%,在粗溴苯提纯过程中,溴苯损失了4%,则可得溴苯多少克(列出计算式即可)。9. 纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,以主要成分为CuFeS2的黄铜矿(含有杂质SiO2)为原料制取纳米Cu2O的一种工艺流程如图所示:
请回答下列问题:
(1)、“滤渣1”中含有硫单质及 , “浸泡”中反应的离子方程式为。(2)、“操作1”的目的是。(3)、“调pH”的过程中能否用CuCO3来代替CuO(填“能”或“否”),要使Fe3+完全沉淀,则溶液的pH至少为(已知该工艺条件下Ksp[Fe(OH)3]≈8×10-38 , Kw≈1×10-14 , lg2≈0.3,化学上认为当离子浓度小于1×10-5mol·L-1时沉淀完全)。(4)、“热还原”的实验现象是。(5)、现代工业也可用铜作电极,电解食盐水制备Cu2O,电解过程中首先生成CuCl(难溶于水),则生成氧化亚铜的化学方程式为;与用黄铜矿制备Cu2O工艺相比电解法的优点有。10. 我国力争实现2030年前碳达峰、2060年前碳中和的目标,CO2的捕集、利用与封存成为科学家研究的重要课题。(1)、CO2甲烷化反应最早由化学家PaulSabatier提出。已知:反应I:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H=+41.2kJ·mol-1
反应II:2CO(g)+2H2(g)⇌CO2(g)+CH4(g) △H=-247.1kJ·mol-1
①CO2甲烷化反应CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)的△H=kJ·mol-1 , 为了提高甲烷的产率,反应适宜在(填“低温”、“高温”、“高压”、“低压”,可多选)条件下进行。
②反应I:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H=+41.2kJ·mol-1 , 已知反应的v正=k正c(CO2)c(H2),v逆=k逆c(H2O)c(CO)(k正、k逆为速率常数,与温度、催化剂有关)若平衡后升高温度,则(填“增大”、“不变”或“减小”);若反应I在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是。
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(CO2):c(H2):c(CO):c(H2O)=1:1:1:1
D.单位时间内,断开C=O键的数目和断开H-O键的数目相同
(2)、在某催化剂表面:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2molCO2和6molH2发生反应,图甲表示压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。
其中表示压强为5.0MPa下CO2的平衡转化率随温度的变化曲线为(填“①”或“②”);b点对应的平衡常数Kp=MPa-2(Kp为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。
(3)、科研人员提出CeO2催化CO2合成碳酸二甲酯(DMC)的反应过程如图乙所示,由图可知其中没有O-H键断裂的步骤是(填“①”“②”或“③”),合成DMC的总反应化学方程式为(CH3OH不需标注同位素原子)。 11. 碳元素能形成多种单质及化合物,在生产生活中有重要的研究和应用价值。请根据以下信息,回答下列问题。(1)、邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。
11. 碳元素能形成多种单质及化合物,在生产生活中有重要的研究和应用价值。请根据以下信息,回答下列问题。(1)、邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。
①在元素周期表中铜位于区(填“s”、“p”、“d”或“ds”)。C、N、O三种元素的电负性由大到小的顺序为。
②邻氨基吡啶的铜配合物中,Cu2+的配位数是 , N原子的杂化类型有。
(2)、化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。①1体积水可溶解约1体积CO2 , 1体积水可溶解约700体积NH3 , NH3极易溶于水的原因是 , 反应时,向饱和NaCl溶液中先通入。
②NaHCO3分解得Na2CO3 , 空间结构为。
(3)、碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是。

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。

一个T-碳晶胞中含有个碳原子,T-碳的密度非常小为金刚石的一半,则T-碳晶胞的边长和金刚石晶胞的边长之比为。
12. 化合物H是合成雌酮激素的中间体,其中-种合成路线如下所示:
已知:
①

②RCOOHRCOCl
请回答下列问题:
(1)、A的化学名称为。(2)、H中的官能团名称为;G到H的反应类型为。(3)、C的结构简式为。(4)、下列有关有机物D的说法正确的是。a.能发生酯化反应也能发生氧化反应
b.1mol的D最多可与4molH2发生反应
c.既有酸性又有碱性
(5)、写出E与碳酸氢钠溶液反应的化学方程式。(6)、X为B的同系物,其相对分子质量比B小14,写出满足如下条件的X的同分异构体的结构简式(不考虑立体异构)。①遇FeCl3溶液发生显色反应;
②苯环上只有2种氢;
③能与碳酸钠溶液反应产生气体。
(7)、根据上述路线中的相关知识,以甲苯为主要原料制备 , 写出合成路线(其他试剂任选)。
, 写出合成路线(其他试剂任选)。