江苏省无锡市宜兴市2022年中考二模化学试题
试卷更新日期:2022-07-12 类型:中考模拟
一、单选题
-
1. 稻谷类食物富含的营养素是( )A、蛋白质 B、油脂 C、糖类 D、维生素2. 地壳中含量最高的金属元素是( )A、Fe B、Na C、Ca D、Al3. 下列物质属于混合物的是( )A、氯化钠 B、金刚石 C、天然气 D、小苏打4. 工业上可用金属钠和氯化钾反应制备金属钾,其化学方程式为:Na+KCl NaCl+K。该反应属于( )A、置换反应 B、复分解反应 C、分解反应 D、化合反应5. 在含有大量的Ba2+、OH-、Cl-的溶液中,还可能大量共存的离子是( )A、 B、Cu2+ C、 D、H+6. 下列变化属于化学变化的是( )A、冰雪融化 B、铁的锈蚀 C、干冰升华 D、氨的液化7. 下列化学用语表达正确的是( )A、2个氯原子:Cl2 B、硅元素:SI C、钠原子结构示意图:
 D、氧化镁中镁元素的化合价:
8. 下列说法正确的是( )A、含有氧元素的化合物一定是氧化物 B、质子数相同的原子一定属于同种元素 C、只含一种元素的物质一定是单质 D、能与稀盐酸反应产生气泡的物质一定是活泼金属9. 下列实验操作正确的是()A、
D、氧化镁中镁元素的化合价:
8. 下列说法正确的是( )A、含有氧元素的化合物一定是氧化物 B、质子数相同的原子一定属于同种元素 C、只含一种元素的物质一定是单质 D、能与稀盐酸反应产生气泡的物质一定是活泼金属9. 下列实验操作正确的是()A、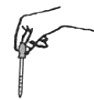 滴加试剂
B、
滴加试剂
B、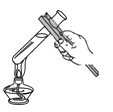 加热液体
C、
加热液体
C、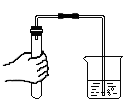 检查气密性
D、
检查气密性
D、 闻气体气味
10. 下列有关物质的性质与用途具有对应关系的是( )A、铝具有导电性,可用于制炊具 B、碳酸钙能与盐酸反应,可用作补钙剂 C、盐酸具有挥发性,可用于除铁锈 D、浓硫酸具有腐蚀性,可用作干燥剂11. NH3的合成为世界粮食增产做出了巨大贡献。一定条件下,向容器中充入一定量的N2和H2 , 充分反应生成NH3。反应前后物质的变化如图,图中X代表的分子是( )
闻气体气味
10. 下列有关物质的性质与用途具有对应关系的是( )A、铝具有导电性,可用于制炊具 B、碳酸钙能与盐酸反应,可用作补钙剂 C、盐酸具有挥发性,可用于除铁锈 D、浓硫酸具有腐蚀性,可用作干燥剂11. NH3的合成为世界粮食增产做出了巨大贡献。一定条件下,向容器中充入一定量的N2和H2 , 充分反应生成NH3。反应前后物质的变化如图,图中X代表的分子是( ) A、N2 B、H2 C、NH3 D、无法确定12. 葡萄糖的分子式为C6H12O6。下列关于葡萄糖的说法正确的是( )A、H、O原子个数比为2∶1 B、相对分子质量为180 g C、分子中含24种元素 D、氧元素的质量分数最小13. 如图为一种烟气脱硫的流程。下列说法错误的是( )
A、N2 B、H2 C、NH3 D、无法确定12. 葡萄糖的分子式为C6H12O6。下列关于葡萄糖的说法正确的是( )A、H、O原子个数比为2∶1 B、相对分子质量为180 g C、分子中含24种元素 D、氧元素的质量分数最小13. 如图为一种烟气脱硫的流程。下列说法错误的是( ) A、烟气脱硫能减少酸雨的形成 B、脱硫塔中发生的主要反应为CaS+SO2+O2CaSO4+S C、理论上,生产过程中无需补充CaS D、理论上每处理64.0吨SO2 , 会排放出44.0吨CO214. 在给定条件下,下列选项所示的物质间转化能实现的是( )A、Cu CuO CuSO4溶液 B、S SO2 H2SO4溶液 C、Fe3O4 Fe FeCl3溶液 D、NaOH溶液 Na2CO3溶液 NaCl溶液15. 常温下,通过下列实验探究Ca(OH)2的性质:
A、烟气脱硫能减少酸雨的形成 B、脱硫塔中发生的主要反应为CaS+SO2+O2CaSO4+S C、理论上,生产过程中无需补充CaS D、理论上每处理64.0吨SO2 , 会排放出44.0吨CO214. 在给定条件下,下列选项所示的物质间转化能实现的是( )A、Cu CuO CuSO4溶液 B、S SO2 H2SO4溶液 C、Fe3O4 Fe FeCl3溶液 D、NaOH溶液 Na2CO3溶液 NaCl溶液15. 常温下,通过下列实验探究Ca(OH)2的性质:实验1:向两支试管中分别加入0.2 g Ca(OH)2粉末,然后各加入2 mL水,振荡后静置,试管底部有粉末,溶液呈无色。
实验2:向两支试管中再各滴入2滴酚酞溶液,振荡后静置,溶液由无色变为红色,试管底部粉末无明显变化。
实验3:继续向其中一支试管中加入2 mL水,振荡后静置,无明显变化;向另一只试管中加入2 mL稀盐酸,振荡后静置,溶液由红色变为无色,试管底部的粉末消失。
下列说法正确的是( )
A、实验1说明常温下Ca(OH)2不溶于水 B、实验2中溶液变红是因为Ca(OH)2在水溶液中解离出Ca2+ C、实验3中消失的Ca(OH)2固体溶解在稀盐酸所含的水中 D、实验3中溶液由红色变为无色的原因是Ca(OH)2+2HCl=CaCl2+2H2O16. 将200g溶有物质M的溶液从95℃降低到10℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是( )温度/℃
95
90
80
30
10
析出M的质量/g
0
0
15
100
116
A、95℃时该溶液为饱和溶液 B、M的溶解度随温度的升高而减小 C、30℃时析出M后所得溶液中含100g水 D、从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法17. 下列操作能达到实验目的的是( )选项
实验目的
操作
A
干燥CO2气体
将气体通过碱石灰(NaOH和CaO的混合物)
B
除去NaCl溶液中含有的少量Na2CO3杂质
向NaCl溶液中加入适量的Ca(NO3)2溶液,过滤
C
鉴别NH4Cl和KCl两种化肥
取两种化肥,分别加入少量熟石灰粉末,混合研磨,闻气味
D
配制5%的KNO3溶液
向盛有5g KNO3固体的烧杯中,加入100mL蒸馏水,搅拌
A、A B、B C、C D、D18. 某小组设计了如图1装置定量探究铁锈蚀的因素。先检查气密性,将5g铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2mL饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上,采集数据,测得温度与压强的曲线如图2所示。查阅资料:一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。下列说法错误的是( )
 A、对比AB段和BC段说明加氯化钠溶液前,铁锈蚀较慢 B、t2时刻后温度开始降低,说明铁生锈的反应已经停止 C、t1~t3时刻装置内压强变小是因为铁锈蚀消耗氧气 D、t3时刻压强突然变大的原因是注射器内盐酸被吸入烧瓶,反应产生较多氢气
A、对比AB段和BC段说明加氯化钠溶液前,铁锈蚀较慢 B、t2时刻后温度开始降低,说明铁生锈的反应已经停止 C、t1~t3时刻装置内压强变小是因为铁锈蚀消耗氧气 D、t3时刻压强突然变大的原因是注射器内盐酸被吸入烧瓶,反应产生较多氢气二、选择题组
-
19. 阅读下列资料,完成下面小题:CO2的绿色利用可实现“资源转化”。
报道一:在一定条件下,利用太阳能可将CO2热解为碳和氧气;
报道二:2021年9月23日中科院新闻发布会上,介绍了天津工业生物技术研究所首次实现从CO2到淀粉分子的全合成,这一科研成果使淀粉生产从传统农业种植模式转向工业车间生产模式成为可能,是颠覆性的技术新突破。
(1)、报道一中需利用缺铁氧化物(如Fe0.9O),相关转化如图所示。下列说法正确的是( ) A、图中Fe0.9O和Fe3O4均为催化剂 B、缺铁氧化物Fe0.9O中Fe呈+2价 C、图中化合价发生变化的元素有C、O D、66.4 g缺铁氧化物和足量CO2完全反应可生成1.2 g C(2)、报道二中的前两步转化可简化表示为:①利用催化剂将高浓度CO2在高密度氢能作用下转化为甲醇(CH3OH);②甲醇再和氧气反应转化为甲醛(HCHO)。下列说法正确的是( )A、两步转化反应均为化合反应 B、两步转化反应中碳元素化合价均未发生改变 C、甲醇、甲醛和淀粉都是人类重要的营养物质 D、一定条件下,甲醇、甲醛均可和氧气反应生成CO2和H2O
A、图中Fe0.9O和Fe3O4均为催化剂 B、缺铁氧化物Fe0.9O中Fe呈+2价 C、图中化合价发生变化的元素有C、O D、66.4 g缺铁氧化物和足量CO2完全反应可生成1.2 g C(2)、报道二中的前两步转化可简化表示为:①利用催化剂将高浓度CO2在高密度氢能作用下转化为甲醇(CH3OH);②甲醇再和氧气反应转化为甲醛(HCHO)。下列说法正确的是( )A、两步转化反应均为化合反应 B、两步转化反应中碳元素化合价均未发生改变 C、甲醇、甲醛和淀粉都是人类重要的营养物质 D、一定条件下,甲醇、甲醛均可和氧气反应生成CO2和H2O三、填空题
-
20. 积极保护生态环境可实现人与自然的和谐共处。(1)、下列做法会加剧温室效应的是(填字母,下同)。
a.植树造林 b.燃煤供暖 c.风力发电
(2)、下列防治“白色污染”的正确方法是。a.使用可降解塑料 b.露天焚烧废旧塑料 c.直接填埋废弃塑料
(3)、下列物质可用于净水的是。a.纯碱 b.硝酸 c.明矾
21. 化学与生活密切相关。(1)、某学校的营养早餐配料标签如图所示,该配料中富含油脂的物质是。餐具上的油污可以用加入洗涤剂的水洗掉,其去污原理是。 (2)、一种创可贴中间有个凸起的小囊区,如图。按贴伤口的同时,小囊区内的水和硝酸铵固体被挤破混合,利用硝酸铵固体溶解时温度 , 起到快速止血的作用。
(2)、一种创可贴中间有个凸起的小囊区,如图。按贴伤口的同时,小囊区内的水和硝酸铵固体被挤破混合,利用硝酸铵固体溶解时温度 , 起到快速止血的作用。 22. 合金材料的研发促进了人类社会的进步。
22. 合金材料的研发促进了人类社会的进步。 (1)、国产大飞机C919机身蒙皮使用的是第三代铝锂合金材料。由于铝锂合金更小,所以相比同体积的普通铝合金质量更小。(2)、镁合金被誉为“21世纪绿色金属结构材料”。Mg17Al12是一种特殊的镁合金,通常选择真空熔炼而非空气中熔炼的原因是(任写一个化学方程式)。该合金是一种储氢材料,完全吸氢后得到MgH2和Al,“储氢过程”属于(填“物理”或“化学”)变化。23. 《天工开物》中记载了采矿和冶炼金属锡的场景。
(1)、国产大飞机C919机身蒙皮使用的是第三代铝锂合金材料。由于铝锂合金更小,所以相比同体积的普通铝合金质量更小。(2)、镁合金被誉为“21世纪绿色金属结构材料”。Mg17Al12是一种特殊的镁合金,通常选择真空熔炼而非空气中熔炼的原因是(任写一个化学方程式)。该合金是一种储氢材料,完全吸氢后得到MgH2和Al,“储氢过程”属于(填“物理”或“化学”)变化。23. 《天工开物》中记载了采矿和冶炼金属锡的场景。 (1)、采矿(图1) “水锡……其质黑色……愈经淘取”。水中淘取锡砂(指锡矿石)时,所用容器的孔径需(选填“大于”或“小于”)锡砂颗粒大小。锡砂主要成分为SnO2 , (选填“易”或“难)溶于水。(2)、冶炼(图2) “凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
(1)、采矿(图1) “水锡……其质黑色……愈经淘取”。水中淘取锡砂(指锡矿石)时,所用容器的孔径需(选填“大于”或“小于”)锡砂颗粒大小。锡砂主要成分为SnO2 , (选填“易”或“难)溶于水。(2)、冶炼(图2) “凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”①鼓入足量空气能使木炭从而提高炉温。
②炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出,其原因是。
(3)、使用①锡往往与其它金属制成合金使用,目的是(选填 “增大”或“减小”)硬度。
②古代锡器常用来饮酒喝茶,很少装酸性物质,原因是。
四、综合题
-
24. 某兴趣小组制取氧气。可能用到的部分装置如下图。
 (1)、上图中仪器a的名称是。(2)、用双氧水和MnO2制氧气。发生反应的化学方程式为 , 收集氧气的装置可选用(填字母)。(3)、查阅文献资料,加热氯酸钾和二氧化锰的混合物,有如下反应发生:
(1)、上图中仪器a的名称是。(2)、用双氧水和MnO2制氧气。发生反应的化学方程式为 , 收集氧气的装置可选用(填字母)。(3)、查阅文献资料,加热氯酸钾和二氧化锰的混合物,有如下反应发生:i、2KClO3+2MnO2=2KMnO4+Cl2↑+O2↑
ii、KMnO4分解产生K2MnO4、MnO2和O2
iii、Cl2+K2MnO4=2KCl+MnO2+O2
①发生装置应选用(填字母)。
②反应ii的化学方程式为。
③反应中MnO2的作用是。
25. 以天然石膏(主要成分CaSO4 , 杂质MgSO4等)为原料可制备硫酸铵和氯化钙。 (1)、“碳化”中发生反应的化学方程式有:(NH4)2CO3 +CaSO4=CaCO3↓+(NH4)2SO4和。写出硫酸铵的一种用途:。(2)、“浸取”中所发生化学反应的反应类型是反应。为了提高“浸取”的效果,可采取的措施有:适当升高温度、。(3)、“除镁”中发生反应的化学方程式为。(4)、用盐酸“酸化”的目的是。26. 化学兴趣小组对“CO还原Fe2O3粉末”的实验进行探究:(1)、Ⅰ、探究CO与Fe2O3的反应产物(夹持仪器已略去)
(1)、“碳化”中发生反应的化学方程式有:(NH4)2CO3 +CaSO4=CaCO3↓+(NH4)2SO4和。写出硫酸铵的一种用途:。(2)、“浸取”中所发生化学反应的反应类型是反应。为了提高“浸取”的效果,可采取的措施有:适当升高温度、。(3)、“除镁”中发生反应的化学方程式为。(4)、用盐酸“酸化”的目的是。26. 化学兴趣小组对“CO还原Fe2O3粉末”的实验进行探究:(1)、Ⅰ、探究CO与Fe2O3的反应产物(夹持仪器已略去)
【实验过程】步骤1 在通风橱中,按上图连接装置并检验装置的气密性。
步骤2 装入试剂:玻璃管内装入Fe2O3粉末,试管Ⅰ中装入澄清石灰水。
步骤3 从a端通入CO一段时间,待排尽空气后,再点燃酒精灯。
【实验现象】反应一段时间后,玻璃管内粉末由色变成黑色,生成的黑色固体均能被玻璃管上方的磁铁吸引。试管Ⅰ中出现白色沉淀(用化学反应方程式表示:)。
【查阅资料】铁粉、FeO、Fe3O4均为黑色固体;铁粉、Fe3O4均能被磁铁吸引。
【提出猜想】对磁铁吸引的黑色固体成分有以下三种猜想:
猜想Ⅰ:Fe;猜想Ⅱ:Fe3O4;猜想Ⅲ:Fe和Fe3O4
【实验验证】取少量反应后的黑色固体放入试管中,加入足量的硫酸铜溶液,振荡,充分反应后静置,观察到红色固体中混有黑色颗粒,说明(填“猜想Ⅰ”、“猜想
(2)、【拓展研究】进一步查阅资料,发现CO能溶于铜液[醋酸二氨合铜(I)和氨水的混合液]。因此可在装置Ⅰ后再连接如图装置Ⅱ,其目的是 , 装置Ⅰ、Ⅱ的连接顺序:b连接(填“c”或“d”)。
Ⅱ、原料气CO的制备
方法一:加热MgCO3、Zn的混合物可快速制备CO,同时还得到两种金属氧化物:、(填化学式)。
方法二:加热草酸晶体(H2C2O4·2H2O)制备CO:H2C2O4·2H2OCO↑+CO2↑+3H2O
已知:常压下,草酸晶体的熔点为101℃,比较草酸晶体的熔点和分解温度,分析若选用如图装置Ⅲ制备装置Ⅰ所需的CO,可能存在的问题是。
 27. NaCl是一种重要的化工原料。(1)、粗盐中含可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐:
27. NaCl是一种重要的化工原料。(1)、粗盐中含可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐:
①“滤渣”中含有(填化学式)。
②“操作X”的名称为。
(2)、以NaCl和NH4HCO3为原料可制备另一种重要的化工原料Na2CO3。步骤1 称取一定质量的NaCl,加水溶解。
步骤2 向其中加入一定质量的NH4HCO3 , 充分反应。
步骤3 过滤、洗涤、干燥、加热可得Na2CO3。
已知:NaHCO3受热易分解:2NaHCO3Na2CO3+H2O+CO2↑。
相关物质的溶解度曲线如图所示。

①步骤2中反应的化学方程式为。
②图10中碳酸氢铵溶解度在30 ℃后无数据的原因可能是。
(3)、为了分析上述所制得的Na2CO3晶体中是否含有NaHCO3 , 取晶体进行如下实验:Ⅰ定性分析
称取m1 g 晶体,利用如图装置(夹持仪器略)分析晶体的成分。

①反应一段时间后,能说明晶体中含有NaHCO3的现象为。
②将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2 g。若1∶1<m1∶m2 < , 也能说明晶体中含有NaHCO3。
③甲同学认为通过测定装置B中沉淀的质量,即可确定晶体的组成。请对甲同学的观点进行评价:。
Ⅱ定量分析
步骤1:取2.500 g晶体于锥形瓶中,加水使样品完全溶解。向锥形瓶中逐滴滴加溶质质量分数为1%的稀盐酸,当Na2CO3恰好完全转化为NaHCO3时,发生反应的化学方程式为:Na2CO3+HCl=NaHCO3+NaCl,反应消耗稀盐酸83.19 g。
步骤2:向步骤1所得的溶液中继续逐滴滴加溶质质量分数为1%的稀盐酸,至NaHCO3恰好完全反应时,发生反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,又消耗稀盐酸86.84 g。
④晶体中NaHCO3的质量分数为(写出计算过程)。
⑤乙同学认为做完步骤1即可确定晶体的组成。请对乙同学的观点进行评价:。
-