湖北省九师联盟2022届高三5月质量检测化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 化学与生产、生活等密切相关,下列有关说法中错误的是( )A、碳酸镁和氢氧化铝等均可作抗酸胃药 B、漂白液、漂白粉的有效成分均是次氯酸钙 C、CO、甲醛等都是室内空气污染物 D、中和法和沉淀法是常用的工业污水处理方法2. 下列化学用语表达正确的是( )A、的结构式:
 B、甲酸乙酯的结构简式:
C、的电子式:
B、甲酸乙酯的结构简式:
C、的电子式: D、沉淀溶解平衡方程式:
3. 实验室制取、收集NH3 , 并组装NH3的喷泉实验装置。下列图示装置和原理能达到实验目的的是( )A、制NH3
D、沉淀溶解平衡方程式:
3. 实验室制取、收集NH3 , 并组装NH3的喷泉实验装置。下列图示装置和原理能达到实验目的的是( )A、制NH3 B、干燥NH3
B、干燥NH3 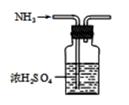 C、收集NH3
C、收集NH3  D、喷泉实验装置
D、喷泉实验装置  4. 对于下列实验,能正确描述其反应的离子方程式的是( )A、检验废液中含: B、通过灼热铁粉: C、将溶液和稀混合: D、用过量氨水吸收工业尾气中的:5. 下列有关物质结构与性质的说法中正确的是( )A、碳正离子呈平面三角形 B、是第四周期未成对电子数最多的元素 C、物质的熔沸点:(金刚石) D、冰分子中的化学键-氢键可以表示为6. 下列实验方案设计能达到实验目的的是( )
4. 对于下列实验,能正确描述其反应的离子方程式的是( )A、检验废液中含: B、通过灼热铁粉: C、将溶液和稀混合: D、用过量氨水吸收工业尾气中的:5. 下列有关物质结构与性质的说法中正确的是( )A、碳正离子呈平面三角形 B、是第四周期未成对电子数最多的元素 C、物质的熔沸点:(金刚石) D、冰分子中的化学键-氢键可以表示为6. 下列实验方案设计能达到实验目的的是( )选项
实验目的
方案设计
A
结合能力比强
向溶液中滴加溶液,有沉淀生成
B
除去晶体中少量的杂质
先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液
C
检验乙醇中是否含有水
将金属钠投入盛有乙醇的试管中,观察是否有气泡产生
D
验证相对大小:
向50.1溶液中滴加5~6滴0.1溶液后,继续滴加0.1的溶液,观察现象
A、A B、B C、C D、D7. 氢叠氮酸[ , ]是无色有刺激性气味的液体,常用于引爆剂,可通过反应制得。下列说法中错误的是( )A、上述反应中,既是氧化产物,也是还原产物 B、、、均具有还原性 C、、、均属于弱电解质 D、、、分子中均存在极性键和非极性键8. 尿素[]可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为。下列说法错误的是( )A、电负性: B、基态电子排布式为 C、与尿素分子中的N原子杂化方式相同 D、C、N原子中电子占据能量最高的轨道形状相同9. 为阿伏加德罗常数的值。下列叙述正确的是( )A、1与足量完全反应,转移的电子数一定为4 B、2.0g由和组成的混合物中含有的电子数为 C、1分子中氧原子形成的共用电子对数为3 D、3.36L和4.8g中含有的氧原子数均一定为0.310. 常温常压下,乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,其中A、B为多孔铂电极。下列有关说法错误的是( ) A、电极B是电池的正极 B、离子交换膜为阴离子交换膜 C、电路中通过1电子,两极溶液质量相差71g D、电极A的电极反应式为11. 五种短周期元素X、Y、Z、W、M的原子序数依次增大且位于不同的主族,Y的最外层电子数是次外层的2倍,M的原子序数等于Y和W的原子序数之和,只有Y、Z、W同周期。下列说法错误的是( )A、简单离子半径: B、X、Y、W三种元素可形成多种化合物 C、M的最高价氧化物对应的水化物为强酸 D、Y、Z、M均可与X形成电子数相等的分子12. 如图1是立方晶胞结构,图2为结构,图3为晶胞结构。
A、电极B是电池的正极 B、离子交换膜为阴离子交换膜 C、电路中通过1电子,两极溶液质量相差71g D、电极A的电极反应式为11. 五种短周期元素X、Y、Z、W、M的原子序数依次增大且位于不同的主族,Y的最外层电子数是次外层的2倍,M的原子序数等于Y和W的原子序数之和,只有Y、Z、W同周期。下列说法错误的是( )A、简单离子半径: B、X、Y、W三种元素可形成多种化合物 C、M的最高价氧化物对应的水化物为强酸 D、Y、Z、M均可与X形成电子数相等的分子12. 如图1是立方晶胞结构,图2为结构,图3为晶胞结构。
下列说法错误的是( )
A、晶胞中,的配位数是8 B、晶胞中,与H之间的最短距离为 C、中存在离子键、配位键和共价键 D、1个晶胞中含有2个钠原子13. 有机物G是一种含有多官能团的化合物,其结构如图所示。下列有关说法正确的是( ) A、G中含有5种官能团(不包括苯环) B、一定条件下G能发生消去反应生成碳碳双键 C、1G最多能与3反应 D、1G最多能与11发生加成反应14. 最近科学家采用真空封管法制备的磷化硼纳米颗粒,作与合成[]反应的催化剂,在发展非金属催化剂实现电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
A、G中含有5种官能团(不包括苯环) B、一定条件下G能发生消去反应生成碳碳双键 C、1G最多能与3反应 D、1G最多能与11发生加成反应14. 最近科学家采用真空封管法制备的磷化硼纳米颗粒,作与合成[]反应的催化剂,在发展非金属催化剂实现电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
下列说法正确的是( )
A、与生成和的反应为放热反应 B、上述反应生成的副产物中,比多(相同条件下) C、在合成甲醇的过程中,降低能量变化,可提高反应速率 D、反应过程中有极性键和非极性键的断裂和生成15. 室温下,向某和的混合溶液巾逐滴加入溶液。溶液中与的变化关系如图所示(已知室温下:的、分别为、)。下列说法正确的是( ) A、a、b、c三点中,溶液中的pH最大的是a点 B、b点溶液中存在: C、a→b对应的溶液中:的值减小 D、a点对应溶液中,c(H+)的数量级为
A、a、b、c三点中,溶液中的pH最大的是a点 B、b点溶液中存在: C、a→b对应的溶液中:的值减小 D、a点对应溶液中,c(H+)的数量级为二、综合题
-
16. 碘化亚铜()可用作有机反应催化剂。某化学兴趣小组以黄铜矿(主要成分为 , 其中的化合价为+2)为原料制备的流程如下:

已知:是白色粉末,不溶于水,能与过量继续反应: , 从而溶于溶液中。
回答下列问题:
(1)、“浸取”时,反应的化学方程式为;该步骤使用的溶液的浓度为560 , 则其物质的量浓度为(保留2位小数)。(2)、“滤渣处理”过程中发生的基本反应类型为。(3)、“溶解”时,被还原为 , 写出该反应的离子方程式:。(4)、“转化”时生成的离子方程式为 , 该步骤需要控制溶液的用量,其原因是。(5)、用溶液洗涤沉淀的目的是。(6)、已知: , , 取2.00g放入锥形瓶中,加入100a溶液,充分振荡后,测得溶液中 , 则a约为(保留1位小数,溶液体积变化忽略不计)。17. 有机物H是合成呋喃香豆素类化合物的重要中间体,其一种合成路线如下:
回答下列问题:
(1)、A中含氧官能团的名称为(酚)羟基、。(2)、E→F的反应类型为。(3)、C的结构简式为。(4)、写出F与新制的悬浊液反应的化学方程式:。(5)、符合下列条件的G的同分异构体有种(不含立体异构)。①苯环上有四个取代基,其中有两个取代基相同;
②含有碳碳三键和酯基,且处于对位;
③能发生银镜反应、水解反应,与溶液能发生显色反应。
其中核磁共振氢谱峰面积之比为2∶2∶2∶1∶1的结构简式为(任写出其中一种)。
(6)、参照上述合成路线,设计以 为原料制备
为原料制备 的合成路线流程图:(其他无机试剂任用)。 18. 碘酸钙[ , 难溶于水,不溶于乙醇,无味]是重要的化工原料,用途广泛。其制备方法主要是以碘为原料,采用氧化法(氧化剂:、、),先制备 , 然后再利用复分解反应制备。回答下列问题:(1)、氧化法制备。
的合成路线流程图:(其他无机试剂任用)。 18. 碘酸钙[ , 难溶于水,不溶于乙醇,无味]是重要的化工原料,用途广泛。其制备方法主要是以碘为原料,采用氧化法(氧化剂:、、),先制备 , 然后再利用复分解反应制备。回答下列问题:(1)、氧化法制备。将通入含有的沸腾蒸馏水中,被氧化为 , 再用石灰乳进行中和、分离、洗涤沉淀、干燥,获得。
①实验室若利用溶液与浓盐酸反应制备一瓶干燥纯净的 , 连接顺序为→jh(按气流方向,用小写字母表示)。
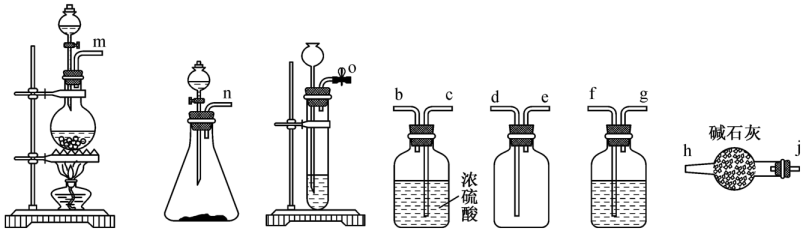
②在含的沸腾蒸馏水中反应生成 物只有两种,写出该反应的化学方程式:;加入石灰乳进行中和时,发生副反应的离子方程式为。
(2)、氧化法制备。Ⅰ.制备
在如图(夹持仪器和加热装置已省略)所示的三颈烧瓶中加入一定量的I2、和蒸馏水,再加入盐酸,控制 , 反应温度85℃。回流反应1.5小时。

Ⅱ.制备
将Ⅰ所得混合液倒入250烧杯中,滴加溶液,调节 , 用滴管逐滴加入1的溶液,不断搅拌,至沉淀完全,经冷却、过滤、洗涤、干燥获得。
①装置C的作用是吸收反应生成的(填化学式)及挥发出的 , 以免污染环境。
②实验时,装置A中控制反应温度的方法是。
③步骤Ⅱ洗涤的试剂为;若该步骤中pH>10,则可能出现的后果是。
④产品中质量分数的测定
称取1.50g产品,加入10高氯酸溶解,转移到250容量瓶中定容。移取25.00溶液于锥形瓶中,再加入1高氯酸,20足量溶液,几滴淀粉溶液作指示剂,用0.10的溶液滴定至终点,重复三次,平均消耗45.00溶液(已知:;高氯酸不参与氧化还原反应)。样品中的质量分数为%(保留2位小数)。
19. 基双金属催化甲烷重整反应可以得到用途广泛的合成气和。回答下列问题:(1)、已知:① ;② 。
则反应 。
(2)、在2L恒容密闭容器中通入2.0、2.0 , 在不同温度下发生反应: , 。测得平衡时混合气体的平均相对分子质量(M)与温度的变化关系如图所示,则
①(填“>”“<”或“=”)0。
②B点对应温度下的平衡转化率为。
③1000℃条件下,C点的反应速率:v(正)(填“>”“<”或“=”)v(逆)。
④A点对应温度下该反应的平衡常数
(3)、某条件下,甲烷重整过程中发生主反应的同时,还可能发生积碳反应:歧化: ;
裂解: 。
①研究表明,温度和压强对积碳反应中平衡碳量的影响如图a和图b所示,其中表示温度和压强对的裂解反应中平衡碳量影响的是(填“图a”或“图b”),简述所选择该图的理由:。
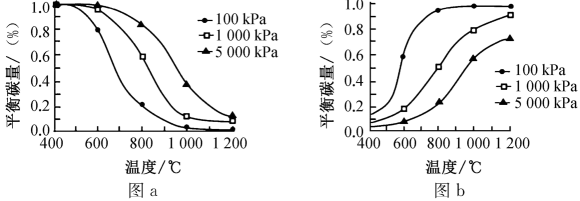
②在重整反应中,低温、高压时会有显著积碳产生,由此可推断,该条件下,对于该重整反应而言,其积碳主要由(填“歧化”或“裂解”)反应产生。
③研究发现,产生积碳反应除歧化、裂解外,与 , 与之间反应也可产生积碳,写出相应的化学方程式:(任写一个)。