新疆维吾尔自治区2022届高三第二次适应性检测理科综合化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 化学与人类生活、社会可持续发展密切相关。下列说法错误的是( )A、目前汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 B、用CO2合成可降解的聚碳酸酯塑料,可以实现“碳"的循环利用 C、“木活字”是由元代王祯创制的用于印刷的活字,“木活字”的主要成分是纤维素 D、“鹳鱼石斧图”彩陶缸是我国出土的一件珍贵历史文物,彩陶缸的主要成分是硅酸盐2. M是一种常见药物中间体,结构简式如下图所示,下列有关说法错误的是( )
 A、M的分子式为C11H18O5 B、M可以发生加成反应、氧化反应、取代反应 C、M环上的一氯取代物有6种(不考虑立体异构) D、1 mol M最多可以与3 mol NaOH反应3. 某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线。下列说法错误的是( )
A、M的分子式为C11H18O5 B、M可以发生加成反应、氧化反应、取代反应 C、M环上的一氯取代物有6种(不考虑立体异构) D、1 mol M最多可以与3 mol NaOH反应3. 某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线。下列说法错误的是( ) A、该过程所发生反应的化学方程式:K2CO3+HCl =KCl+KHCO3;KHCO3+HCl=KCl+H2O+CO2↑ B、混合物样品中含碳酸钾20.0g C、混合物中碳元素的质量分数为9. 77% D、若将61.4 g原混合物样品充分加热,放出CO2的质量为4.40g4. 由下列实验操作及现象所得结论正确的是( )
A、该过程所发生反应的化学方程式:K2CO3+HCl =KCl+KHCO3;KHCO3+HCl=KCl+H2O+CO2↑ B、混合物样品中含碳酸钾20.0g C、混合物中碳元素的质量分数为9. 77% D、若将61.4 g原混合物样品充分加热,放出CO2的质量为4.40g4. 由下列实验操作及现象所得结论正确的是( )选项
实验操作及现象
结论
A
向某溶液中加入70%硫酸溶液后加热,并将气体产物依次通过品红溶液和澄清石灰水,品红溶液褪色,澄清石灰水变浑浊
该溶液中含亚硫酸盐
B
向蛋白质溶液中加入饱和氯化铵溶液,有固体析出
蛋白质发生了变性
C
将变黑的银器浸入盛有NaCl溶液的铝制容器中,银器由黑变白
生成了Ag
D
用pH计测CH3COONa溶液和NaF溶液的pH,前者大于后者
Ka(HF)>Ka( CH3COOH)
A、A B、B C、C D、D5. X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族; X、 Y、Z三种元素形成的化合物具有强氧化性,能灭活新冠病毒,其结构如图所示。下列叙述错误的是( ) A、该化合物含极性键和非极性键 B、该化合物中各元素原子均达稳定结构 C、Z、W形成的简单离子半径,Z大于W D、由X、Y、Z、W四种元素形成的化合物一定能与X、Z、W形成的化合物反应6. 电解合成1 ,2-二氯乙烷的实验装置如图所示。下列说法中错误的是( )
A、该化合物含极性键和非极性键 B、该化合物中各元素原子均达稳定结构 C、Z、W形成的简单离子半径,Z大于W D、由X、Y、Z、W四种元素形成的化合物一定能与X、Z、W形成的化合物反应6. 电解合成1 ,2-二氯乙烷的实验装置如图所示。下列说法中错误的是( ) A、a为电源正极 B、该装置总反应为CH2 =CH2 +2NaCl+2H2OClCH2CH2Cl+2NaOH+H2 C、X、Y依次为阳离子交换膜、阴离子交换膜 D、液相反应为CH2 =CH2+2CuCl2 = ClCH2CH2Cl+ 2CuCl(s)7. 25℃时,向25 mL 0.1 mol ·L-1邻苯二甲酸(H2A)溶液中加入KOH固体,混合溶液的pH随-lgc(HA-)以及-1gc(A2- )的关系如图所示(忽略溶液体积变化和邻苯二甲酸的挥发)。下列有关叙述错误的是( )
A、a为电源正极 B、该装置总反应为CH2 =CH2 +2NaCl+2H2OClCH2CH2Cl+2NaOH+H2 C、X、Y依次为阳离子交换膜、阴离子交换膜 D、液相反应为CH2 =CH2+2CuCl2 = ClCH2CH2Cl+ 2CuCl(s)7. 25℃时,向25 mL 0.1 mol ·L-1邻苯二甲酸(H2A)溶液中加入KOH固体,混合溶液的pH随-lgc(HA-)以及-1gc(A2- )的关系如图所示(忽略溶液体积变化和邻苯二甲酸的挥发)。下列有关叙述错误的是( ) A、邻苯二甲酸的Ka1约为1. 0×10-3 B、b点有关微粒浓度大小关系为 c(K+ )>c(HA- )>c(H+)>c(A2-)>c(OH-) C、从b点到e点;水电离的c(H+)一直增大 D、pH= 10时,= 104.2
A、邻苯二甲酸的Ka1约为1. 0×10-3 B、b点有关微粒浓度大小关系为 c(K+ )>c(HA- )>c(H+)>c(A2-)>c(OH-) C、从b点到e点;水电离的c(H+)一直增大 D、pH= 10时,= 104.2二、非选择题
-
8. 综合利用炼锌矿渣(主要含铁酸镓Ga2( Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓( GaN) ,部分工艺流程如下:
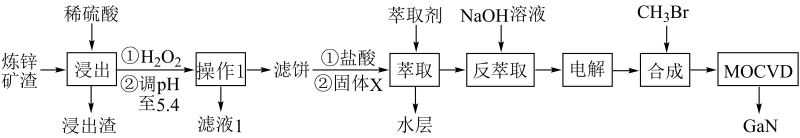
已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1金属离子浓度 及开始沉淀的pH
金属离子
浓度( mol· L-1)
开始沉淀pH
Fe2+
1.0×10-3
8.0
Fe3+
4.0×10-2
1.7
Zn2+
1.5
5.5
Ga3+
3.0×10-3
3.0
表2金属离子的萃取率
金属离子
萃取率(%)
Fe2+
0
Fe3+
99
Zn2+
0
Ga3+
97-98.5
(1)、“浸出”时ZnFe2O4发生反应的化学方程式为。(2)、滤液1中可回收利用的物质是 , 滤 饼的主要成分是;萃取前加入的固体X为 , 加入X的目的是。(3)、Ga与Al同主族,化学性质相似。反萃取后,镓的存在形式为(填化学式)。(4)、电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,以NaOH溶液为电解液,阴极的电极反应为。(5)、GaN可采用MOCVD (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为。(6)、滤液1中残余的Ga3+的浓度为mol·L-1。9. 我国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为FeS2和FeCO3 , 实验室为测定FeS2和FeCO3的物质的量之比,利用如图所示装置进行实验。(已知:硫酸铜溶液与H2S反应生成CuS黑色沉淀),实验步骤如下:
I.按图示连接仪器,检查装置气密性后加入药品;
II.打开K1、K2 , 通入一段时间氮气,关闭K1、K2 , 取下干燥管E称其质量( m1 )后再连接好装置;
III.打开K1和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去O2的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质) ,待反应完成后,打开K2通入一段时间氮气;
IV.关闭K1、K2 , 取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100 mL溶液备用;
V.取下干燥管E并称其质量(m2);
VI.取IV中所得溶液25.00mL于锥形瓶中,用0.200mol·L-1酸性KMnO4溶液滴定。
回答下列问题:
(1)、装置A中盛稀硫酸的仪器的名称为;若撤去装置F,则测得的FeCO3的含量会(填“偏大”“偏小”或“无影响”)。(2)、步骤III中反应完成后,打开K2通入一段时间氮气的目的是。(3)、实验过程中发现装置B中有黑色沉淀生成,写出装置A中FeS2与稀硫酸反应的化学方程式: 。(4)、C装置的作用是。(5)、步骤VI中发生反应的离子方程式为 , 到达滴定终点的现象是。(6)、若上述实验中m2-m1=2.2 g,步骤VI消耗0. 200 mol·L-1酸性KMnO4溶液20. 00 mL,则该矿石样品中n( FeS2) :n( FeCO3)=。10. 医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:I.工业上主要采用乙烯直接水合法(CH2 =CH2+H2O→CH3CH2OH)制乙醇。
(1)、在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:i. CH2 =CH2+H3O++H2O
ii. +H2O
iii. +H2OCH3CH2OH+H3O+
随着反应进程,该过程能量变化如图1所示。

下列有关说法正确的是 (填字母标号,下同)。
a.该反应过程中i~ iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c. 和是反应的中间产物
(2)、已知:C2H4(g) +H2O(g) C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v 逆=k逆c( C2H5OH) ,其中k正、k 逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是____。A、k正增大,k 逆减小 B、k正减小,k 逆增大 C、k正减小的倍数大于k 逆 D、k正减小的倍数小于k 逆(3)、II.工业用二氧化碳加氢可合成乙醇:2CO2(g)+6H2(g) C2H5OH(g) +3H2O(g)保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应, CO2的平衡转化率与温度、投料比m[]的关系如图2所示。
投料比由大到小的顺序为。
(4)、若投料比m=1,一定温度下发生反应,下列说法不能作为反应是否达平衡依据的是 (填标号)。a.容器内气体密度不再变化
b.容器内气体中均相对分子质量不再变化
c. CO2的体积分数不再变化
d.容器内不再变化
e.断裂3NA个H-H键的同时生成l.5NA个水分子
(5)、若m3=3,则A点温度下,该反应的平衡常数Kp的数值为(MPa) -4(Kp是以分压表示的平衡常数) ;若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时CO2的转化率50%(填“>”“=”或“<”)。(6)、用熔融碳酸盐为电解质将2C2H5OH(1) +6NO2( g) 3N2(g)+4CO2(g) +6H2O(1)反应设计为原电池,以达到利用NO2废气的目的,正极电极反应式为 , 若电路中通过2 mol电子,理论上处理NO2 L( 标准状况下)。11. 2020年,自修复材料、自适应材料、新型传感材料等智能材料技术大量涌现,为生物医疗、国防军事以及航空航天等领城发展提供支撑。(1)、我国科研工作者基于丁二酮肟氨酯基团的多重反应性,研制了一种强韧、自愈的超级防护材料,其中的分子机制如图所示。
Cu在元素周期表中位于区,M层中核外电子能量最高的电子云在空间有个伸展方向。C、N、O第一电离能由大到小的顺序为。
(2)、氧化石墨烯基水凝胶是一类新型复合材料,对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:
还原石墨烯中碳原子的杂化方式是 , 上图中氧化石墨烯转化为还原石墨烯时,1号C与其相邻C原子间键能的变化是(填“变大”“变小”或“不变”),二者当中在水溶液中溶解度更大的是 (填物质名称) ,原因为。
(3)、砷化硼是近期受到广泛关注的一种III- V 半导体材料。砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:B:(0,0,0);( , , 0);( , 0,);(0, , )
As:( , , );( , , );( , , );( , , )
请在图中画出砷化硼晶胞的俯视图 , 已 知晶体密度为d g/cm3 ,As半径为a pm,假设As、B原子相切,则B原子的半径为 pm(写计算表达式)。
 12. 反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一、根据该合成路线回答下列问题:
12. 反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一、根据该合成路线回答下列问题:
已知:
 RCHO+R’OH+R”OH(1)、A的名称是;B分子中共面原子数目最多为。(2)、D中非含氧官能团的名称是 , 写出检验D中含氧官能团的化学反应方程式。(3)、E为有机物,能发生的反应有____。A、聚合反应 B、加成反应 C、消去反应 D、取代反应(4)、F是B的同分异构体,与B具有完全相同的官能团,写出F所有可能的结构(不包括立体异构)。(5)、以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
RCHO+R’OH+R”OH(1)、A的名称是;B分子中共面原子数目最多为。(2)、D中非含氧官能团的名称是 , 写出检验D中含氧官能团的化学反应方程式。(3)、E为有机物,能发生的反应有____。A、聚合反应 B、加成反应 C、消去反应 D、取代反应(4)、F是B的同分异构体,与B具有完全相同的官能团,写出F所有可能的结构(不包括立体异构)。(5)、以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。 (6)、问题(5)的合成路线中第一步反应的目的是。
(6)、问题(5)的合成路线中第一步反应的目的是。