上海市普陀区2022届高三适应性练习(二模)化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 2022年北京冬奥会采用的制冷剂是( )A、硝石 B、氟利昂 C、二氧化碳 D、液氨2. 已知某微粒的核外电子排布式是1s22s22p63s23p4 , 下列判断错误的是( )A、该元素在周期表的位置是第三周期IVA族 B、该元素最高价是+6,最低价是-2 C、该微粒原子核外有16种运动状态不同的电子 D、该微粒原子核外有5种能量不同的电子3. 下列物质的性质或用途不涉及氧化还原反应的是( )A、Na2O2用作制氧剂 B、小苏打用作食品膨松剂 C、含氯消毒剂用于环境消毒 D、大气中NO2参与酸雨形成4. 下列物质不能起到消毒杀菌作用的是( )A、明矾 B、紫外线 C、75%酒精 D、漂粉精5. 下列物质不属于合金的是( )A、奥运金牌 B、青铜器 C、生铁 D、水银6. 含有共价键的离子化合物是( )A、SiO2 B、CaCl2 C、NH4Cl D、CH2Cl27. C60与现代足球
 有很相似的结构,它与石墨互为( ) A、同位素 B、同素异形体 C、同分异构体 D、同系物8. 关于CH≡CH和
有很相似的结构,它与石墨互为( ) A、同位素 B、同素异形体 C、同分异构体 D、同系物8. 关于CH≡CH和 的结构与性质,下列说法错误的是( ) A、CH≡CH是非极性分子 B、
的结构与性质,下列说法错误的是( ) A、CH≡CH是非极性分子 B、 存在单双键交替的结构
C、两者的最简式都是CH
D、CH≡CH的空间构型是直线形
9. 关于化工生产的叙述中,符合生产实际的是( )A、石油化工中,采用干馏的方法把石油分成不同沸点范围的产品 B、硫酸工业中,利用热交换器预热反应物,降低能耗提高生产效率 C、纯碱工业中,侯氏制碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率 D、合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率10. 关于实验室制备乙酸丁酯的实验,下列叙述错误的是( )A、不能用水浴加热 B、长玻璃管起冷凝回流作用 C、加入过量乙酸可以提高1-丁醇的转化率 D、提纯乙酸丁酯需要用水、氢氧化钠溶液洗涤11. 下列有关金属及其化合物的应用不合理的是( )A、含有废铁屑的FeCl2溶液,可用于除去工业废气中的Cl2 B、盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良 C、铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业 D、钢铁设施采用“牺牲阳极的阴极保护法”时,表面连接的金属一定比铁活泼12. 下列实验合理的是( )A、用新制氢氧化铜悬浊液(必要时可加热)鉴别甲酸与乙酸 B、用澄清石灰水鉴别SO2与CO2 C、用淀粉-KI试纸鉴别碘水与FeCl3溶液 D、用湿润的pH试纸测定CH3COONa的pH13. 关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是( )A、NH3中H元素被氧化 B、NO2发生氧化反应 C、氧化产物与还原产物的质量之比为4∶3 D、反应中每生成1.4molN2 , 有1.6molNH3被还原14. 下列反应改变某种条件,不会改变生成物的是( )A、Cl2与NaOH溶液的反应:改变NaOH溶液的温度 B、Al与H2SO4溶液的反应:改变H2SO4溶液的浓度 C、H2S与O2的燃烧反应:改变O2的量 D、S与O2的燃烧反应:改变O2的量15. 昆虫信息素是昆虫之间传递信号的化学物质,人工合成信息素用于诱捕害虫、测报虫情等。一种信息素的结构简式如图所示,关于该化合物的说法错误的是( )
存在单双键交替的结构
C、两者的最简式都是CH
D、CH≡CH的空间构型是直线形
9. 关于化工生产的叙述中,符合生产实际的是( )A、石油化工中,采用干馏的方法把石油分成不同沸点范围的产品 B、硫酸工业中,利用热交换器预热反应物,降低能耗提高生产效率 C、纯碱工业中,侯氏制碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率 D、合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率10. 关于实验室制备乙酸丁酯的实验,下列叙述错误的是( )A、不能用水浴加热 B、长玻璃管起冷凝回流作用 C、加入过量乙酸可以提高1-丁醇的转化率 D、提纯乙酸丁酯需要用水、氢氧化钠溶液洗涤11. 下列有关金属及其化合物的应用不合理的是( )A、含有废铁屑的FeCl2溶液,可用于除去工业废气中的Cl2 B、盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良 C、铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业 D、钢铁设施采用“牺牲阳极的阴极保护法”时,表面连接的金属一定比铁活泼12. 下列实验合理的是( )A、用新制氢氧化铜悬浊液(必要时可加热)鉴别甲酸与乙酸 B、用澄清石灰水鉴别SO2与CO2 C、用淀粉-KI试纸鉴别碘水与FeCl3溶液 D、用湿润的pH试纸测定CH3COONa的pH13. 关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是( )A、NH3中H元素被氧化 B、NO2发生氧化反应 C、氧化产物与还原产物的质量之比为4∶3 D、反应中每生成1.4molN2 , 有1.6molNH3被还原14. 下列反应改变某种条件,不会改变生成物的是( )A、Cl2与NaOH溶液的反应:改变NaOH溶液的温度 B、Al与H2SO4溶液的反应:改变H2SO4溶液的浓度 C、H2S与O2的燃烧反应:改变O2的量 D、S与O2的燃烧反应:改变O2的量15. 昆虫信息素是昆虫之间传递信号的化学物质,人工合成信息素用于诱捕害虫、测报虫情等。一种信息素的结构简式如图所示,关于该化合物的说法错误的是( ) A、其分子式为C12H20O2 B、可发生水解反应 C、具有一定的挥发性 D、1mol该物质最多可与2molH2发生加成反应16. W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z,化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )A、原子半径:r(Z)>r(Y)>r(X)>r(W) B、非金属性:W>X>Y>Z C、含有Z的含氧酸均为强酸 D、Y的最高价氧化物的水化物是强碱17. 能正确表示反应的离子方程式是( )A、FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+ B、CuSO4溶液中滴加稀氨水:Cu2++2OH-=Cu(OH)2↓ C、(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓ D、SO2使酸性高锰酸钾溶液褪色:3SO2+2MnO+4H+=3SO+2Mn2++2H2O18. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Al(s)NaAlO2(aq)Al(OH)3(s) B、NaCl(aq)NaHCO3(s)Na2CO3(s) C、NaBr(aq)Br2(aq)I2(aq) D、Fe2O3(s)Fe(s)FeCl3(aq)19. 下列溶液中微粒浓度关系一定正确的是( )A、氨水与氯化铵的pH=7的混合溶液中:[Cl-]=[NH] B、0.1mol·L-1的硫酸铵溶液中:[NH]>[SO]>[H+] C、0.01mol·L-1的一元酸和0.01mol·L-1的一元强碱等体积混合:[H+]=[OH-] D、0.1mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]20. 探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L−1 H2C2O4的pH=1.3)
A、其分子式为C12H20O2 B、可发生水解反应 C、具有一定的挥发性 D、1mol该物质最多可与2molH2发生加成反应16. W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z,化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )A、原子半径:r(Z)>r(Y)>r(X)>r(W) B、非金属性:W>X>Y>Z C、含有Z的含氧酸均为强酸 D、Y的最高价氧化物的水化物是强碱17. 能正确表示反应的离子方程式是( )A、FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+ B、CuSO4溶液中滴加稀氨水:Cu2++2OH-=Cu(OH)2↓ C、(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓ D、SO2使酸性高锰酸钾溶液褪色:3SO2+2MnO+4H+=3SO+2Mn2++2H2O18. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Al(s)NaAlO2(aq)Al(OH)3(s) B、NaCl(aq)NaHCO3(s)Na2CO3(s) C、NaBr(aq)Br2(aq)I2(aq) D、Fe2O3(s)Fe(s)FeCl3(aq)19. 下列溶液中微粒浓度关系一定正确的是( )A、氨水与氯化铵的pH=7的混合溶液中:[Cl-]=[NH] B、0.1mol·L-1的硫酸铵溶液中:[NH]>[SO]>[H+] C、0.01mol·L-1的一元酸和0.01mol·L-1的一元强碱等体积混合:[H+]=[OH-] D、0.1mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]20. 探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L−1 H2C2O4的pH=1.3)实验
装置
试剂a
现象
①

Ca(OH)2溶液(含酚酞)
溶液褪色,产生白色沉淀
②
少量NaHCO3溶液
产生气泡
③
酸性KMnO4溶液
紫色溶液褪色
④
C2H5OH和浓硫酸
加热后产生有香味物质
由上述实验所得草酸性质所对应的方程式错误的是( )
A、H2C2O4有酸性,Ca(OH)2+ H2C2O4 CaC2O4↓+2H2O
B、酸性:H2C2O4> H2CO3 , NaHCO3+ H2C2O4
CaC2O4↓+2H2O
B、酸性:H2C2O4> H2CO3 , NaHCO3+ H2C2O4 NaHC2O4+CO2↑+H2O
C、H2C2O4具有还原性,2+5+16H+
NaHC2O4+CO2↑+H2O
C、H2C2O4具有还原性,2+5+16H+ 2Mn2++10CO2↑+ 8H2O
D、H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OHC2H5OOCCOOC2H5+2H2O
2Mn2++10CO2↑+ 8H2O
D、H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OHC2H5OOCCOOC2H5+2H2O
二、非选择题
-
21. Na、K属于碱金属元素,其形成的物质在生活生产中有广泛应用。NaCl不仅可以作调味剂,在工业生产中也占据着重要地位。(1)、写出Na+电子式 , 比较Na+和Cl-的半径大小 , NaCl属于晶体。(2)、NaCl是氯碱工业的原料,此工业可以制取的产品有(至少写出2种)。(3)、KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为:_I2+_KClO3+_→_KH(IO3)2+5KCl+3Cl2↑。配平该反应的化学方程式。反应中生成的Cl2可用吸收制备漂粉精。
NaHCO3俗称小苏打,可用于治疗胃酸过多。
(4)、有实验小组利用pH传感器探究Na2CO3和NaHCO3的性质,实验过程如表所示。实验操作
实验数据


写出Na2CO3与澄清石灰水反应的离子方程式 , OH-未参与该反应的实验证据是。
(5)、结合离子方程式说明NaHCO3可用于治疗胃酸过多的原因。胃酸过多易引起胃溃疡,小苏打可用于治疗胃溃疡,如果处于胃溃疡的活动期,医生不建议服用小苏打,请猜测医生不建议的原因。22. 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。以CO2、H2为原料合成CH3OH涉及的主要反应如下:I.CO2(g)+3H2(g)CH3OH(g)+H2O(g)+49.5 kJ
II.CO(g)+2H2(g)CH3OH(g)+90.4 kJ
III.CO2(g)+H2(g)CO(g)+H2O(g)-40.9 kJ
(1)、根据反应I的热化学方程式,在图中绘制反应方向箭头,标出反应物、生成物和能量变化。 (2)、在反应II中标出电子转移的方向和数目。(3)、①一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为mol·L-1 (用含a、b、V的代数式表示)。
(2)、在反应II中标出电子转移的方向和数目。(3)、①一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为mol·L-1 (用含a、b、V的代数式表示)。②不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定的CH3OH的平衡产率(图甲)和CO2平衡转化率(图乙)随温度的变化关系如图所示。

已知:CH3OH的平衡产率×100%
CO2平衡转化率×100%
图甲中压强p1、p2、p3由大到小的顺序是;图乙中T1温度时,三条曲线几乎交于一点的原因是。
③为同时提高CH3OH的平衡产率和CO2平衡转化率,应选择的反应条件是(填编号)。
a.低温、高压 b.低温、低压 c.高温、低压 d.高温、高压
23. 天然产物M具有抗疟活性,某科学活动小组以化合物A为原料合成M及其衍生物N的路线如图(部分反应条件省略,Ph表示-C6H5):
已知:

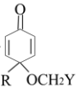
完成下列填空:
(1)、写出化合物A中含氧官能团的结构简式 , M→N的反应试剂和条件。(2)、反应①的方程式可表示为A+G→B+Z,化合物Z的分子式是 , 反应②③④中属于还原反应的有 , 属于加成反应的有。(3)、化合物C能发生银镜反应,其结构简式为。(4)、写出一种满足下列条件的化合物N的芳香族同分异构体的结构简式。①能与NaHCO3溶液反应;②能与3倍物质的量的Na发生产生H2的反应;③核磁共振氢谱确定分子中有6种化学环境不相同的氢原子;④不含手性碳原子(手性碳原子是指连有4个不同的原子或原子团的饱和碳原子)。
(5)、根据上述信息,写出以对甲基苯酚( )和HOCH2CH2Cl为原料合成
)和HOCH2CH2Cl为原料合成 的路线(其他无机试剂任选)。
的路线(其他无机试剂任选)。(合成路线常用的表达方式为:AB……目标产物)
24. 为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。完成下列填空:(1)、I.甲方案实验原理:CuSO4+BaCl2=BaSO4↓+CuCl2
实验步骤:

判断SO沉淀完全的操作是。
(2)、步骤①的操作名称是 , 步骤②判断沉淀是否洗净所选用的试剂是 , 步骤③灼烧时盛装样品的仪器名称是 , 根据固体wg求得c(CuSO4)=mol·L-1。(3)、II.乙方案实验原理:Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑
实验步骤:
①按如图安装装置(夹持仪器略去);
②……
③在仪器A、B、C、D、E中加入图示的试剂;
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录;
⑤将CuSO4溶液滴入A中并搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生;
⑥将体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录;
⑦处理数据。

步骤②为。步骤⑥需保证体系恢复到室温的原因是(填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(4)、Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下ρ(H2)=dg•L-1 , 则c(CuSO4)=mol·L-1(列出计算表达式)。若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)(填“偏高”“偏低”或“无影响”)。