上海市虹口区2021-2022学年高三下学期学习能力诊断测试化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 科学家发观在超流体中溶解时会吸热,能达到的低温。关于和的说法正确的是( )A、中子数相同 B、质量数相同 C、化学性质相同 D、物理性质相同2. 天然晶体称为水晶,是古代重要宝石品种。有关的说法错误的是( )A、属于原子晶体 B、属于非电解质 C、属于酸性氧化物 D、含有键3. 羟胺()外观呈白色结晶状,在有机合成中常作还原剂。下列关于羟胺说法正确的是( )A、易溶于水 B、属于铵盐 C、属于有机物 D、存在非极性键4. 下列事实与共价键的强弱无关的是( )A、金刚石熔点高于晶体硅 B、碘化氢的沸点高于氯化氢 C、氮气化学性质很稳定 D、乙炔易发生加成反应5. 下列各组反应物如果改变某一条件,生成物种类一定不变的是( )A、与:改变温度 B、与氨水:改变氨水浓度 C、和浓硫酸:改变温度 D、与共热:改变溶剂种类6. 除去下列物质中含有的少量杂质(括号内为杂质),所用除杂试剂合理的是( )A、溶液 B、催化剂 C、溶液():铁粉 D、:饱和溶液7. 关于 , 说法正确的是(表示阿伏加德罗常数的值)( )A、体积是 B、密度是的2倍 C、含有个电子 D、溶于水形成个分子8. 检验下列溶液是否变质,所选试剂或试纸肯定合理的是( )
选项
A
B
C
D
溶液
Na2SO3溶液
FeSO4溶液
KI溶液
NaOH溶液
所选试剂或试纸
BaCl2溶液
KSCN溶液
AgNO3溶液
广泛pH试纸
A、A B、B C、C D、D9. 仅从烧杯、玻璃棒、分液漏斗、胶头滴管、蒸发皿、电子天平、滤纸中选择器材(省略夹持装置),能完成的实验是( )A、硫酸铜溶液的浓缩结晶 B、配制溶液 C、除去中的少量 D、除去乙酸乙酯中的少量乙酸10. 用已知浓度盐酸滴定未知浓度溶液,甲基橙作指示剂。若测定结果偏低,可能原因是( )A、滴定管用蒸馏水洗净后未用盐酸润洗 B、盛装待测液的锥形瓶水洗后未烘干 C、滴定过程中振荡锥形瓶时不慎有少量液体溅出 D、滴定至锥形瓶中溶液颜色由橙变红,且内不改变时停止11. 已知非金属元素X、Y的单质能发生如下反应 , 下列说法正确的是( )A、氧化产物: B、氧化性: C、非金属性: D、每生成 , 转移电子12. 臭氧层中某转化过程的能量变化如图所示。下列说法正确的是( )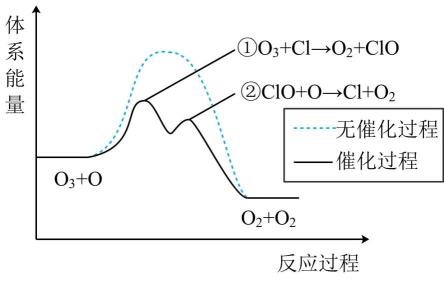 A、经过催化过程,反应热效应不变 B、是该反应的催化剂 C、催化过程中反应①②均为放热反应 D、该转化过程总反应为13. 醇类化合物
A、经过催化过程,反应热效应不变 B、是该反应的催化剂 C、催化过程中反应①②均为放热反应 D、该转化过程总反应为13. 醇类化合物 发生分子内脱水,可能得到的二烯烃有( ) A、1种 B、2种 C、3种 D、4种14. 侯德榜先生于1943年创立了“侯氏制碱法”。该工艺中一般不涉及的离子反应是( )A、 B、 C、 D、15. 金刚烷(Z)具有高度对称性,其衍生物在医药方面有着重要用途。以化合物X为起始原料,经过如下过程可以制得金刚烷。
发生分子内脱水,可能得到的二烯烃有( ) A、1种 B、2种 C、3种 D、4种14. 侯德榜先生于1943年创立了“侯氏制碱法”。该工艺中一般不涉及的离子反应是( )A、 B、 C、 D、15. 金刚烷(Z)具有高度对称性,其衍生物在医药方面有着重要用途。以化合物X为起始原料,经过如下过程可以制得金刚烷。
有关说法错误的是( )
A、X能使酸性高锰酸钾溶液褪色 B、Y分子中同时含有三个五元碳环 C、Z的一氯代物共有4种 D、Y与Z互为同分异构体16. 短周期元素X、Y、Z、W原子序数依次增大。常温下,四种元素最高价氧化物对应水化物均能形成浓度为的溶液,它们的分布如下图所示。下列说法正确的是( ) A、X与W可能位于同一主族 B、最外层未成对电子数: C、四种元素的简单离子中Y的半径最小 D、四种元素的最高价氧化物对应水化物中Z的酸性最强17. 乙酸叔丁酯(M)的某合成反应历程如下图所示。下列说法正确的是( )
A、X与W可能位于同一主族 B、最外层未成对电子数: C、四种元素的简单离子中Y的半径最小 D、四种元素的最高价氧化物对应水化物中Z的酸性最强17. 乙酸叔丁酯(M)的某合成反应历程如下图所示。下列说法正确的是( ) A、该合成反应的类型属于加成反应 B、该历程中存在非极性键的断裂与生成 C、Y中所有碳原子最外层均已达到8电子稳定结构 D、如果使用含的X为原料,则M中不含18. 向密闭容器中加入一定量 , 下发生反应: , 保持温度不变,容器内最终二氧化碳浓度与容器容积的关系如图所示。下列说法正确的是( )
A、该合成反应的类型属于加成反应 B、该历程中存在非极性键的断裂与生成 C、Y中所有碳原子最外层均已达到8电子稳定结构 D、如果使用含的X为原料,则M中不含18. 向密闭容器中加入一定量 , 下发生反应: , 保持温度不变,容器内最终二氧化碳浓度与容器容积的关系如图所示。下列说法正确的是( ) A、平衡常数值: B、从 , 平衡逆向移动 C、容积为时,的平衡分解率为 D、容积为时,再加入一定量 , 的浓度不发生变化19. 燃煤烟气脱硫脱氮对解决雾霾污染很重要。下图是种电化学烟气净化装置。有关说法正确的是( )
A、平衡常数值: B、从 , 平衡逆向移动 C、容积为时,的平衡分解率为 D、容积为时,再加入一定量 , 的浓度不发生变化19. 燃煤烟气脱硫脱氮对解决雾霾污染很重要。下图是种电化学烟气净化装置。有关说法正确的是( ) A、该装置实现了电化学固氮 B、电极I为正极,发生氧化反应 C、物质X可能是 D、工作过程中溶液减小20. 在时,将氨水以固定速率滴入盐酸中,溶液和温度随加入氨水体积变化如下表所示。下列有关说法正确的是( )
A、该装置实现了电化学固氮 B、电极I为正极,发生氧化反应 C、物质X可能是 D、工作过程中溶液减小20. 在时,将氨水以固定速率滴入盐酸中,溶液和温度随加入氨水体积变化如下表所示。下列有关说法正确的是( )序号
①
②
③
④
加入氨水体积
0
10.00
b
25.00
溶液温度
25
28
27
25
溶液
0.0
a
7.0
9.4
A、水的电离程度: B、③中一定等于 C、②→④溶液温度下降说明水解过程是吸热的 D、若将盐酸换成等浓度的醋酸,则②的温度将高于二、非选择题
-
21. 硫的化合物在工业中用途广泛。是一种重要的溶剂。工业上可以利用硫黄()与为原料制备 , 时受热分解成气态 , 发生反应。
完成下列填空:
(1)、和互称为;硫原子最外层未成对电子中运动状态不相同的方面是。(2)、反应所涉及的各物质中,属于极性分子的电子式为。列举一个能比较硫元素与碳元素非金属性相对强弱的实验事实:。常温下,用的溶液处理工业尾气中的 , 吸收过程中的使用率()与溶液的关系如图所示(溶液体积与温度均保持不变)。 (3)、a点时,溶液中。已知到b点时吸收了标准状况下尾气,则尾气中的体积分数为(尾气中其他成分不反应)。(4)、当的使用率达到时,溶液为4.4,分析原因:。(5)、用硫酸酸化的 , 溶液处理气体,会析出铬钾矾晶体。写出相关反应的化学方程式。22. 氮氧化物()的任意排放会造成酸雨、光化学烟雾等环境污染问题,其与悬浮在大气中的海盐粒子相互作用时,发生反应:。
(3)、a点时,溶液中。已知到b点时吸收了标准状况下尾气,则尾气中的体积分数为(尾气中其他成分不反应)。(4)、当的使用率达到时,溶液为4.4,分析原因:。(5)、用硫酸酸化的 , 溶液处理气体,会析出铬钾矾晶体。写出相关反应的化学方程式。22. 氮氧化物()的任意排放会造成酸雨、光化学烟雾等环境污染问题,其与悬浮在大气中的海盐粒子相互作用时,发生反应:。完成下列填空:
(1)、该反应的平衡常数表达式。(2)、①若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是(选填编号)。a. b.和NO的物质的量之和保持不变
c.混合气体密度保持不变 d.
上述反应可以视作分两步进行:
(i)……
(ii)
②反应i的化学方程式可能是。反应ii中反应物化学键总能量生成物化学键总能量(填“高于”“低于”或“等于”)。
(3)、保持恒温条件,将充入不同容积的密闭容器中进行反应ii,充分反应达到平衡后,反应物的转化率与容器容积及不同温度的关系如下图所示:
①图中的关系为(填“>”“<”或“=”);A、B、C各自对应化学平衡常数大小关系是。
②若从起始到处于A点状态共经过 , 该时间段内化学反应速率。
工业中利用新型催化剂M催化氦气与NO反应生成 , 从而去除NO的影响: , 相同时间内,NO的去除率随反应温度的变化曲线如下图所示。
 (4)、在范围内随着温度的升高,NO的去除率上升的原因可能是(任写一点):。23. Bevyxxa是一种凝血因子抑制剂,可用于静脉血栓的治疗,其合成路线如下所示:
(4)、在范围内随着温度的升高,NO的去除率上升的原因可能是(任写一点):。23. Bevyxxa是一种凝血因子抑制剂,可用于静脉血栓的治疗,其合成路线如下所示:
已知:
 +
+
 +H2O
+H2O完成下列填空:
(1)、反应①的试剂与条件为;反应③的反应类型是。(2)、反应②过程中,转化为(均填基团名称)。(3)、X的结构简式为。(4)、写出同时满足下列条件的Y的一种同分异构体的结构简式。i.属于芳香化合物,分子中存在三种化学环境不同的氢原子;
ii.含有
 结构,且能发生银镜反应。(5)、苏合香醇(
结构,且能发生银镜反应。(5)、苏合香醇( )与A互为同分异构体。仅以苏合香醇为有机原料可以合成青霉素培养基原料苯乙酰胺(
)与A互为同分异构体。仅以苏合香醇为有机原料可以合成青霉素培养基原料苯乙酰胺( ),请写出合成路线。 24. 是一种高性能磁性材料。实验室以为原料制备的流程如下:
),请写出合成路线。 24. 是一种高性能磁性材料。实验室以为原料制备的流程如下:第一步:将向浊液中通入 , 发生反应;
第二步:向溶液中加入 , 有气体逸出,同时获得粗产品。
已知部分含锰化合物的溶解性如下:
含锰化合物
溶解性
不溶
不溶
可溶
不溶
完成下列填空:
(1)、①第一步的反应装置如下图所示:
②石灰乳的作用是。
③反应过程中,为使尽可能转化完全,在通入与比例一定,不改变与用量的条件下,可以采取的合理措施有(任写一种)。
(2)、若实验中将换成空气,测得反应液中的浓度随反应时间t变化如图。导致溶液中浓度变化产生明显差异的原因可能是:。 (3)、完成第二步反应的离子方程式: , 实验发现,若用相同物质的量浓度的溶液代替溶液,则得到的中会混有较多的杂质,该杂质可能是(填化学式)。
(3)、完成第二步反应的离子方程式: , 实验发现,若用相同物质的量浓度的溶液代替溶液,则得到的中会混有较多的杂质,该杂质可能是(填化学式)。实验室可以用无色的酸性溶液来检验,原理如下所示:
已知的结构如下图所示。
(4)、标明上述反应的电子转移方向与数目。确认溶液中是否含的操作与现象是:。(5)、利用重量法探究的热分解,数据如下表所示(残留固体均为锰的氧化物):实验
固体质量g
加热前
加热至后
第一组(空气氛围)
3.450
2.610
第二组(氢气氛围)
3.450
2.130
①第二组实验中残留固体的化学式为。
②结合两组实验数据,推测在空气中加热至时发生反应的化学方程式:。