山西省吕梁市交城县2022届高三下学期第一次模拟考试理科综合化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 化学与生产、生活关系密切。下列叙述涉及氧化还原反应的是( )A、从海水中提取镁单质 B、石油的分馏 C、明矾净水 D、小苏打发酵面粉2. 利用下列装置进行实验,操作符合题意且能达到实验目的的是( )
 A、用装置甲制取SO2 B、用装置乙制取NH3 C、用装置丙制取Na2CO3 D、用装置丁分离苯和溴苯3. 设NA为阿伏加德罗常数的值。下列有关说法正确的是( )A、标准状况下,5.6 L CCl4含有的共用电子对数目为NA B、5.6g Fe在足量的Cl2中完全燃烧,失去的电子数为0.2 NA C、4.2 g由乙烯和丙烯组成的混合气体含有碳原子数为0.3 NA D、1 L0.1 mol·L-1 CH3COONa溶液中含CH3COO-的数目为0.1 NA4. 有机化合物F是一种抗血栓药物,其结构简式如图所示。下列有关该有机物的说法错误的是( )
A、用装置甲制取SO2 B、用装置乙制取NH3 C、用装置丙制取Na2CO3 D、用装置丁分离苯和溴苯3. 设NA为阿伏加德罗常数的值。下列有关说法正确的是( )A、标准状况下,5.6 L CCl4含有的共用电子对数目为NA B、5.6g Fe在足量的Cl2中完全燃烧,失去的电子数为0.2 NA C、4.2 g由乙烯和丙烯组成的混合气体含有碳原子数为0.3 NA D、1 L0.1 mol·L-1 CH3COONa溶液中含CH3COO-的数目为0.1 NA4. 有机化合物F是一种抗血栓药物,其结构简式如图所示。下列有关该有机物的说法错误的是( ) A、能与金属钠反应生成氢气 B、能使溴的四氯化碳溶液褪色 C、苯环上氢原子发生氯代时,一氯代物有6种 D、1 mol该分子最多与8 mol H2发生加成反应5. 热激活电池可应用于特殊环境。一种热激活电池的工作原理如图所示,该电池的总反应式为2Li+FeS2= Fe+ Li2S2。下列说法正确的是( )
A、能与金属钠反应生成氢气 B、能使溴的四氯化碳溶液褪色 C、苯环上氢原子发生氯代时,一氯代物有6种 D、1 mol该分子最多与8 mol H2发生加成反应5. 热激活电池可应用于特殊环境。一种热激活电池的工作原理如图所示,该电池的总反应式为2Li+FeS2= Fe+ Li2S2。下列说法正确的是( ) A、放电时Li+向a极移动 B、电子由a电极经熔融介质流向b电极 C、正极的电极反应式为FeS2+2e-= Fe+ D、放电时,若有0.2 mol e- 转移,则正极质量增加5.6 g6. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的原子半径在短周期元素中最大,W与Y同主族。下列说法正确的是( )A、简单离子的半径:Y<W< <Z B、Y、Z形成的化合物可能含有共价键 C、简单氢化物的热稳定性:Y<W D、最高价氧化物对应水化物的酸性:W<X7. 已知:Ka1(H2C2O4)=10-1.3 ,常温下向20.00 mL 0.1 mol· L-1 Na2C2O4溶液中滴入0.1 mol· L-1的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列说法错误的是( )
A、放电时Li+向a极移动 B、电子由a电极经熔融介质流向b电极 C、正极的电极反应式为FeS2+2e-= Fe+ D、放电时,若有0.2 mol e- 转移,则正极质量增加5.6 g6. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的原子半径在短周期元素中最大,W与Y同主族。下列说法正确的是( )A、简单离子的半径:Y<W< <Z B、Y、Z形成的化合物可能含有共价键 C、简单氢化物的热稳定性:Y<W D、最高价氧化物对应水化物的酸性:W<X7. 已知:Ka1(H2C2O4)=10-1.3 ,常温下向20.00 mL 0.1 mol· L-1 Na2C2O4溶液中滴入0.1 mol· L-1的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列说法错误的是( ) A、V(盐酸)= 10.00 mL时:c(Na+ )=c(Cl-) +c( )+2c( ) B、V(盐酸)=20.00 mL时:c(Na+ )>c(Cl- )> c( )>c( )>c(H2C2O4) C、V(盐酸)= 40.00 mL时:c(H2C2O4)=100.2·c( ) D、在滴加盐酸过程中,水的电离程度始终减小
A、V(盐酸)= 10.00 mL时:c(Na+ )=c(Cl-) +c( )+2c( ) B、V(盐酸)=20.00 mL时:c(Na+ )>c(Cl- )> c( )>c( )>c(H2C2O4) C、V(盐酸)= 40.00 mL时:c(H2C2O4)=100.2·c( ) D、在滴加盐酸过程中,水的电离程度始终减小二、实验题
-
8. 高铁酸钾(K2FeO4)是一种绿色净水剂。某课外小组利用KClO与Fe(NO3)3、KOH溶液反应制备K2FeO4 , 其方法是先用Cl2与KOH溶液反应制取KClO,再向KClO溶液中加入KOH、Fe(NO3)3溶液。装置如下图所示(部分夹持装置已省略):

已知:①Cl2与KOH溶液的反应是放热反应,在20℃以下反应生成KClO,在较高温度时则生成KClO3;②K2FeO4易溶于水、微溶于浓KOH溶液,在0~5 ℃的强碱性环境中较稳定。
回答下列问题:
(1)、仪器a的名称是 , 装置A中发生反应的化学方程式为 , 装置B的作用是。(2)、装置C中三颈烧瓶置于冰水浴中的目的是;搅拌的作用是 , 向三颈烧瓶中加入KOH、Fe(NO3)3溶液,搅拌并在0~5 ℃下反应制得K2FeO4 , 反应的离子方程式为。(3)、装置D的作用是。(4)、测定制得K2FeO4样品的质量分数。称取4.0g K2FeO4样品溶于适量的KOH溶液中,向其中加入足量的KCrO2溶液,充分反应后过滤,滤液在250 mL容量瓶中定容。取25. 00 mL加入稀硫酸酸化,用0.2 mol·L-1的(NH4)2 Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为24. 00 mL,K2FeO4样品的质量分数为。已知相关反应为
① + +2H2O=Fe(OH)3↓+ +OH-;
②2 +2H+= +H2O;
③ +6Fe2+ +14H+=6Fe3+ +2Cr3+ +7H2O。
9. 以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2 (SO4)3为原料可以制备脱硫剂ZnFe2O4。该脱硫剂的制备硫化、再生过程可表示为
回答下列问题:
(1)、“浸取”时为加快浸取速率,可以采取的措施有 (任写一条)。(2)、“除杂”包括加适量锌粉、过滤、加H2O2氧化等步骤。“加入H2O2氧化”的目的是 , 除Pb2+和Cu2+外,与锌粉反应的离子还有(填离子符号)。(3)、“沉锌铁”时反应体系温度不能过高,可能的原因是。(4)、400 ℃时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有脱硫剂ZnFe2O4的硫化反应器。①硫化过程中,ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为。
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,但反应前后ZnS的质量不变, ZnS的作用是 , 生成COS的总反应化学方程式为。
(5)、将硫化后的固体在V(N2) : V(O2) =95 : 5的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400 ℃范围内,固体质量增加的主要原因可能是。 10. NOx(主要指NO和NO2)是大气主要污染物之一,有效去除大气中的NOx是环保工作者的重要研究课题。回答下列问题:(1)、已知:
10. NOx(主要指NO和NO2)是大气主要污染物之一,有效去除大气中的NOx是环保工作者的重要研究课题。回答下列问题:(1)、已知:①2NO2(g)+H2O(l)=HNO3 (aq) + HNO2(aq) △H1=-116.1 kJ·mol-1;
②3HNO2 (aq)=HNO3(aq) +2NO(g)+H2O(l) △H2=+75.9 kJ·mol-1。
则3NO2(g)+ H2O(l)=2HNO3 (aq)+NO(g)的△H为。
(2)、在400 ℃、催化剂存在条件下,NH3可以将NO还原为N2和H2O,反应为4NH3(g)+6NO(g) 5N2(g) +6H2O(g) △H<0。在该条件下,向体积为1 L的恒容密闭容器中通入4 mol NH3和6 mol NO发生上述反应,5 min末达到平衡, NO的平衡转化率为90%。①该反应的平衡常数表达式为Kc= ,0~5 min用N2表示该反应的平均速率为mol· L-1·min-1
②400 ℃时,为提高NO的转化率,应选择的反应条件为(填“增大压强”或“减小压强”)。
(3)、NO和H2反应的化学方程式为2NO(g) +2H2(g) N2(g) + 2H2O(g),在T ℃时,1 L恒容密闭容器里,充入0.003molNO和0.006molH2 , 测得体系的总压强p随时间t的变化如下表所示:t/ min
0
10
20
30
40
p/kPa
36
33.8
32
30.4
30.4
t=20 min时,体系中H2的分压p(H2)=kPa,NO的平衡转化率为%(保留一位小数)。
(4)、温度为T° C,向体积不等的恒容密闭容器中分别加入足量活性炭和1 mol NO2 , 发生反应:2C(s)+2NO2(g) N2(g) +2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
①c点时,反应(填“是”或“否”)达到平衡状态。
② (填“>”“=”或“<”) 。
11. 铁、钴、镍等金属及其化合物在科学研究和工业生产中应用非常广泛。回答下列问题:(1)、基态铁原子的核外电子排布式为。(2)、K3[Fe(CN)6 ]溶液可以检验Fe2+。K3[Fe(CN)6]中含有的σ键与π键的数目之比 , 与CN-互为等电子体的分子有(举一例,填化学式)。(3)、酞菁钴的结构简式如图所示,其中三种非金属元素的电负性由大到小的顺序为。 (4)、NiSO4是制备磁性材料和催化剂的重要中间体,的空间构型为 , 硫原子的杂化方式为。(5)、某氮化铁的晶胞结构如图所示:
(4)、NiSO4是制备磁性材料和催化剂的重要中间体,的空间构型为 , 硫原子的杂化方式为。(5)、某氮化铁的晶胞结构如图所示:
①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A(0,0,0);B为( , , );C为(0,1,1)。则D原子的坐标参数为。
②若该晶体的密度是ρg·cm-3 ,则晶胞中两个最近的Fe的核间距为cm(用含ρ的代数式表示,NA表示阿伏加德罗常数的值)。
12. 帕比司他(化合物G)是一种抗肿瘤药物,可用于治疗多发性骨髓瘤,其合成路线如下:
已知:
①R-CHO R-CH=CHCOOH;
②
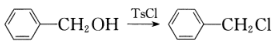 。
。回答下列问题:
(1)、A的名称为 , 已知B的分子式为C8H8O2 ,则B的结构简式为。(2)、C的一种同分异构体X同时满足下列条件,写出该同分异构体的结构简式:。①能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应;
②能发生银镜反应,且1 mol X与足量银氨溶液充分反应能生成4 mol Ag;
③X分子中不同化学环境的氢原子个数比是1 : 1 : 2: 6。
(3)、C→D反应中有一种分子式为C10H8O2的副产物生成,该副产物的结构简式为。(4)、D中含氧官能团的名称为 , E→F的反应类型为。(5)、参照上述合成路线,设计以 和HOOCCH2COOH为原料制备
和HOOCCH2COOH为原料制备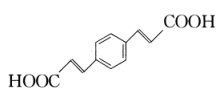 的合成路线:(无机试剂任用)。
的合成路线:(无机试剂任用)。