山东省淄博市2022届高三三模化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 海洋是丰富的资源宝库,山东省科技赋能深耕海洋经济,位于全国之首。下列说法错误的是( )A、从海水中提取的氘用于可控核聚变,氘与氕互为同位素 B、从海水中提取液溴、金属钾和镁的生产过程中,都涉及氧化还原反应 C、海洋藻类浒苔可用于提炼“生物原油”,“生物原油”的主要成分是碳氢化合物 D、全降解血管支架的材料是从虾蟹壳中提取的甲壳质(一种多糖物质),甲壳质属于高分子化合物2. 化学与生活密切相关。下列应用不涉及氧化还原反应的是( )A、甲醛能使蛋白质失去生理活性 B、密封的食品包装中常放置有一小包铁粉 C、市售的食用油中普遍加入叔丁基对苯二酚 D、食用维生素C含量较高的食品有利于铁元素的吸收3. 在“价一类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,相关推断不合理的是( )
 A、b、d、f既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b到c的转化 C、d与c在一定条件下反应可生成b或a D、d在加热条件下与强碱溶液反应生成e和f,且4. 通过电解KI和丙酮的水溶液来制备碘仿。已知:
A、b、d、f既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b到c的转化 C、d与c在一定条件下反应可生成b或a D、d在加热条件下与强碱溶液反应生成e和f,且4. 通过电解KI和丙酮的水溶液来制备碘仿。已知:物质
熔点/℃
沸点/℃
溶解性
丙酮()
-95
56
与水、乙醇互溶
碘仿()
120
218
不溶于水,溶于热乙醇
制得的粗碘仿中含少量石墨粉、丙酮,则分离提纯碘仿的操作中,图中仪器一定不会用到的( )
A、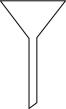 B、
B、 C、
C、 D、
D、 5. 已知X、Y、Z、W是同一短周期主族元素。单质具有强氧化性,可用于杀菌消毒。四种元素与锂离子组成的盐是一种新型的锂离子电池的电解质,结构如图所示(“→”表示配位键)。下列说法正确的是( )
5. 已知X、Y、Z、W是同一短周期主族元素。单质具有强氧化性,可用于杀菌消毒。四种元素与锂离子组成的盐是一种新型的锂离子电池的电解质,结构如图所示(“→”表示配位键)。下列说法正确的是( ) A、原子半径:X>Y>Z>W B、Y的最高价氧化物的水化物为强酸 C、单质氧化性: D、阴离子中四种元素的原子均满足8电子稳定结构6. N-异丙基丙烯酰胺可形成一种高分子膜,在一定温度范围内有温敏特性,结构如图所示。已知酰胺基具有亲水性、异丙基具有疏水性。下列说法错误的是( )
A、原子半径:X>Y>Z>W B、Y的最高价氧化物的水化物为强酸 C、单质氧化性: D、阴离子中四种元素的原子均满足8电子稳定结构6. N-异丙基丙烯酰胺可形成一种高分子膜,在一定温度范围内有温敏特性,结构如图所示。已知酰胺基具有亲水性、异丙基具有疏水性。下列说法错误的是( )
 A、可通过加聚反应合成此高分子膜 B、A过程中,高分子膜有O-H键的形成 C、B过程为降温过程 D、高分子膜在A过程发生体积收缩,原因是酰胺基之间形成了氢键7. 氨基甲酸铵易分解,易水解,难溶于。某小组设计如图所示装置制备氨基甲酸铵。已知:
A、可通过加聚反应合成此高分子膜 B、A过程中,高分子膜有O-H键的形成 C、B过程为降温过程 D、高分子膜在A过程发生体积收缩,原因是酰胺基之间形成了氢键7. 氨基甲酸铵易分解,易水解,难溶于。某小组设计如图所示装置制备氨基甲酸铵。已知:
下列分析错误的是( )
A、A装置的优点是能够随时控制反应的发生和停止 B、装置B,C,E中试剂可分别为饱和碳酸氢钠溶液、浓硫酸、固体 C、装置D使用冰水浴 D、装置F中所用试剂可为与熟石灰8. 钙钛矿光催化剂具有高活性和选择性。带有负电荷的将带正电的固定在其表面,用于可见光驱动还原。下列说法错误的是( ) A、电负性:Br>Pb>Cs B、中的配位数为6 C、三联呲啶中N原子的杂化方式为 D、还原过程中有极性键、非极性键断裂和形成9. 由工业废铜泥(主要成分为、、 , 含少量Fe)制备难溶于水的氯化亚铜,其工艺流程如图。下列说法错误的是( )
A、电负性:Br>Pb>Cs B、中的配位数为6 C、三联呲啶中N原子的杂化方式为 D、还原过程中有极性键、非极性键断裂和形成9. 由工业废铜泥(主要成分为、、 , 含少量Fe)制备难溶于水的氯化亚铜,其工艺流程如图。下列说法错误的是( ) A、灼烧时可将CuS、等转化为CuO B、除杂②过程中还需加热 C、流程中可循环使用的物质有、 D、还原中的反应为10. 水系钠离子电池有望代替锂离子电池和铅酸电池,工作原理如图所示。下列说法错误的是( )
A、灼烧时可将CuS、等转化为CuO B、除杂②过程中还需加热 C、流程中可循环使用的物质有、 D、还原中的反应为10. 水系钠离子电池有望代替锂离子电池和铅酸电池,工作原理如图所示。下列说法错误的是( ) A、放电时,电极N上的电势高于电极M上的电势 B、充电时,光电极参与该过程 C、该交换膜为阴离子交换膜 D、放电时总反应为:11. 下列实验设计不能达到实验目的的是( )
A、放电时,电极N上的电势高于电极M上的电势 B、充电时,光电极参与该过程 C、该交换膜为阴离子交换膜 D、放电时总反应为:11. 下列实验设计不能达到实验目的的是( )选项
实验操作或做法
实验目的
A
制备乙酸乙酯实验中可用饱和溶液洗涤分液
除去乙酸乙酯中的乙醇和乙酸
B
向苯中滴加浓溴水,并加入作催化剂
制取溴苯
C
向中加入大量的水,同时加热,促进水解趋于完全,所得沉淀过滤、焙烧
制备
D
在相同条件下,将颗粒大小相同的钠分别与乙醇、水反应
比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性
A、A B、B C、C D、D二、多选题
-
12. 生育三烯酚有、、和四种结构如图所示,、代表的原子或原子团如表。下列叙述中错误的是( )

H
H
H
H
A、、两种生育三烯酚互为同系物,和两种生育三烯酚互为同分异构体 B、上述四种酚均可使溴水及酸性高锰酸钾溶液褪色,与溶液发生显色反应 C、-生育三烯酚存在顺反异构,不存在对映异构 D、1mol-生育三烯酚与溴水发生反应,理论上最多可消耗4mol13. 为适应不同发电形式产生的波动性,我国科学家设计了一种电化学装置,其原理如图所示。当闭合K1和K3、打开K2时,装置处于蓄电状态;当打开K1和K3、闭合K2时,装置处于放电状态。放电时,双极膜中间层中的H2O解离为H+和OH-并分别向两侧迁移。下列说法错误的是( ) A、蓄电时,碳锰电极的电极反应式为 B、蓄电时,右侧电解池发生的总反应为 C、放电时,每消耗1 mol MnO2 , 理论上有2 mol H+由双极膜向碳锰电极迁移 D、理论上,该电化学装置运行过程中需要补充H2SO4和KOH14. 科研工作者通过计算机模拟和数学计算,设计出三条在含Pt-O结构的化合物中插入CO的反应路径,其相对能量变化如图。下列说法错误的是( )
A、蓄电时,碳锰电极的电极反应式为 B、蓄电时,右侧电解池发生的总反应为 C、放电时,每消耗1 mol MnO2 , 理论上有2 mol H+由双极膜向碳锰电极迁移 D、理论上,该电化学装置运行过程中需要补充H2SO4和KOH14. 科研工作者通过计算机模拟和数学计算,设计出三条在含Pt-O结构的化合物中插入CO的反应路径,其相对能量变化如图。下列说法错误的是( ) A、该反应为放热反应 B、路径Ⅱ中的最大能垒(活化能)为57.2kJ/mol C、反应过程中Pt的成键数目发生了改变 D、路径Ⅲ为主反应15. 某温度下,改变0.10mol/L溶液的pH时,各种含铬元素粒子及浓度变化如图所示。下列有关说法正确的是( )
A、该反应为放热反应 B、路径Ⅱ中的最大能垒(活化能)为57.2kJ/mol C、反应过程中Pt的成键数目发生了改变 D、路径Ⅲ为主反应15. 某温度下,改变0.10mol/L溶液的pH时,各种含铬元素粒子及浓度变化如图所示。下列有关说法正确的是( ) A、 B、 C、E点溶液中存在: D、反应的平衡常数
A、 B、 C、E点溶液中存在: D、反应的平衡常数三、非选择题
-
16. FeSe基超导体是近几年发现并研究的一种新型材料。(1)、基态Se原子的价电子排布式为。基态离子核外电子云轮廓图呈哑铃形的能级上共有个电子。(2)、四氟化铌()的熔点(72℃)低于的熔点(1000℃)的原因可能是。(3)、硝普钠()可用于治疗急性心率衰竭。
①硝普钠中不存在的作用力有(填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键 e.非极性共价键 f.氢键
②C、N、O三种元素中,由其中两种元素按原子个数比为1:3组成的常见阴离子的空间构型为。
(4)、金属锂溶于液氨时发生反应: , 得到反应活性很高的金属电子溶液,则X的化学式为。液氨存在自耦电离 , 则三种微粒的键角由大到小的顺序为。(5)、Li、Fe、Se可形成新型超导材料,晶胞如图所示:
①该晶体的化学式为。
②已知晶胞参数如图所示,晶胞棱边夹角均为90°,设阿伏加德罗常数的值为 , 相对分子质量为M,侧晶体的密度为(列式表示)。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。Li原子①的坐标为 , Se原子②的坐标为 , Se原子③的坐标为 , 则Fe原子④的坐标为;Fe原子的配位数为。
17. 一种抗凝血药物中间体4-(4-氨基苯基)-3-吗啉酮(F)的合成路线如图:(
 )
)已知:Ⅰ.R-X+

 (、Br)
(、Br) Ⅱ.
 +
+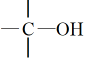 HX+
HX+ (、Br) (1)、实验室制备A的化学方程式为 , 向制得的A的粗产品中加入溶液可以除去杂质。(2)、B的结构简式为 , 符合下列条件的B的同分异构体有种。
(、Br) (1)、实验室制备A的化学方程式为 , 向制得的A的粗产品中加入溶液可以除去杂质。(2)、B的结构简式为 , 符合下列条件的B的同分异构体有种。①遇溶液显紫色②含有四种化学环境的氢。
写出其中苯环上有两个取代基的结构简式。
(3)、C中含氧官能团的名称是 , C→D的化学方程式为。(4)、已知:
 , 综合上述信息及原料,写出由硝基苯和
, 综合上述信息及原料,写出由硝基苯和 制备
制备 的合成路线。 18. 在900℃时,将氯气通过钛铁矿(主要成分FeTiO3)和炭粉的混合物生成四氯化钛和氯化铁,同时产生一种还原性气体。现制取并收集四氯化钛的装置如图所示(夹持装置略去)。
的合成路线。 18. 在900℃时,将氯气通过钛铁矿(主要成分FeTiO3)和炭粉的混合物生成四氯化钛和氯化铁,同时产生一种还原性气体。现制取并收集四氯化钛的装置如图所示(夹持装置略去)。
已知:①TiCl4高温时能与O2反应,不与HCl反应,②TiCl4与FeCl3部分物理性质
熔点/℃
沸点/℃
水溶性
TiCl4
-23.2
136.4
极易水解生成白色沉淀
FeCl3
306
315
易水解生成红褐色沉淀
(1)、组装好仪器,添加试剂前,应该进行的操作是。(2)、用K2Cr2O7与浓盐酸制备Cl2 , 反应的离子方程式为。实验中需先后通入N2两次,第二次通N2时活塞k1、k2的状态为 , 作用是。(3)、900℃时,瓷舟中发生反应的化学方程式为。(4)、控温箱的温度在150~200℃,目的是。(5)、装置单元X的作用是。(6)、利用如图装置测定所得TiCl4的纯度:取w g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴入3滴0.1 mol/LK2CrO4溶液作指示剂,用c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液V mL。已知:常温下,、 , Ag2CrO4呈砖红色。
①安全漏斗在本实验中的作用除加水外,还有。
②达到滴定终点时的现象为。
③产品的纯度为(用含w、c和V的代数式表示)。
19. 以固体废锌催化剂(主要成分为ZnO及少量、CuO、MnO、)为原料制备锌的工艺流程如图:
已知:①“浸取”时。ZnO、CuO转化为、进入溶液;
②25℃时, , ;
③深度除杂标准:溶液中
(1)、为提高锌浸出率,必须采取的措施是;“浸取”温度为30℃时,锌浸出率可达90.6%,继续升温浸出率反而下降,其原因为。(2)、“操作a”的名称为。(3)、“深度除锰”是在碱性条件下将残留的转化为 , 离子方程式为。(4)、“深度除铜”时,锌的最终回收率、除铜效果[除铜效果以反应后溶液中铜锌比表示]与“加入量”[以表示]的关系曲线如图所示。
①当加入量时,锌的最终回收率下降的原因是(用离子方程式表示),该反应的平衡常数为 , (已知的)
②“深度除铜”时加入量最好应选。
a.100% b.110% c.120% d.130%
(5)、测定反萃取水相中的浓度:量取20.00mL反萃取水相于锥形瓶中,用0.0100mol/L EDTA(乙二胺四乙酸钠)标准溶液滴定至终点()。重复实验三次,平均消耗标准溶液22.30mL。则反萃取水相中的浓度为(保留两位小数)。20. 与重整是利用的研究热点之一。该重整反应体系有以下反应:Ⅰ.
Ⅱ.
Ⅲ. (只在高温下自发进行)
(1)、已知25℃、101kPa时、和的燃烧热分别为、和 , 则。 0(填“>”或“<”)。(2)、在一定压强和催化剂的条件下,将等物质的量的和通入重整反应器中,平衡时,、的物质的量分数及转化率随温度变化的关系如图所示。
①平衡时的物质的量分数随温度变化的曲线是(填标号)。
②温度高于1300K后,曲线d超过曲线c的可能原因为。
(3)、在p MPa时,将和按物质的量之比为1∶1充入密闭容器中,分别在无催化剂和催化下反应相同时间,所得的转化率、催化剂活性与温度的关系如图。
①a点转化率相等的原因是。
②在900℃、催化条件下,将、、按物质的量之比为1∶1∶n充入密闭容器,的平衡转化率大于50%,原因是。
(4)、设为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为kPa)除以标准压强]。某温度下反应Ⅲ的 , 向恒容密闭容器中按投料比充入原料气,初始总压为150kPa,发生反应Ⅰ、Ⅱ、Ⅲ,体系达到平衡时的分压为b kPa,则的平衡转化率为。