山东省日照市2022届高三校际联考(三模)化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 化学与科学、技术密切相关,下列说法错误的是( )A、王亚平太空授课,将泡腾片(含酒石酸和碳酸氢钠)溶于水,在水球内产生气泡,发生的是氧化还原反应 B、神舟十三号返回舱侧壁壳体使用的高强度铝合金材料的主要成分是金属单质 C、冬奥火炬“飞扬”外壳使用的碳纤维复合材料能耐高温且在空气中不燃烧 D、冬奥场馆使用制冷剂制冰是物理过程2. 下列说法正确的是( )A、波长为的紫外光的光子能量大于蛋白质中的、、键的键能,因而会灼伤皮肤 B、浓硝酸与碳在加热条件下得到的红棕色气体一定是被碳还原生成的 C、镀锌或镀铜的钢管破损后均会加快钢管的腐蚀 D、硅胶、生石灰、均可用作食品干燥剂3. 和可以反应生成氨硼烷。下列说法错误的是( )A、的沸点高于 B、和中N、B的杂化方式相同 C、中,含有的键数为 D、B原子的基态原子核外电子空间运动状态有3种4. X、Y、Z、W为原子序数依次增大的四种短周期元素,x的核外电子总数与其周期数相同,Y的基态原子的价层电子中有3个未成对电子,乙的最外层电子数为其内层电子数的3倍;Z与W同主族。下列说法正确的是( )A、离子半径: B、键角: C、气态氢化物的热稳定性: D、第一电离能:5. 下列实验操作对应的现象及所得结论均正确的是( )
选项
实验操作
现象
结论
A
将用皮毛摩擦过的橡胶棒靠近三氯甲烷液流
三氯甲烷的流动方向未发生改变
三氯甲烷是非极性分子
B
将溶液与溶液混合
有白色絮状沉淀产生
结合质子的能力:
C
向盛有丙烯醛的试管中加入溴水
溴水褪色
丙烯醛中含有碳碳双键
D
将铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体
加热时无明显现象,加入硝酸钾后溶液变蓝
硝酸钾起催化作用
A、A B、B C、C D、D6. 巴豆酸乙酯的键线式结构如下图所示,下列有关该物质的说法错误的是( ) A、化学式为 B、存在顺反异构 C、该分子中处于同一平面的原子数最多有11个 D、该物质能发生取代、加成、氧化、还原等反应7. 实验室用下图所示装置,探究室温下与的反应,所用镁条质量和表面积相同,且均已用砂纸打磨,实验2的镁条放在尖嘴玻璃导管内并浸于蒸馏水中,实验3产生的浑浊物主要为碱式碳酸镁。下列说法错误的是( )
A、化学式为 B、存在顺反异构 C、该分子中处于同一平面的原子数最多有11个 D、该物质能发生取代、加成、氧化、还原等反应7. 实验室用下图所示装置,探究室温下与的反应,所用镁条质量和表面积相同,且均已用砂纸打磨,实验2的镁条放在尖嘴玻璃导管内并浸于蒸馏水中,实验3产生的浑浊物主要为碱式碳酸镁。下列说法错误的是( )实验1
实验2
实验3



镁条表面有微小气泡,且溶液较长时间无明显变化
镁条表面有较多气泡且产生气泡速率逐渐加快,溶液中无明显现象
镁条表面有大量气泡,溶液逐渐变浑浊
A、实验1现象不明显,可能与表面生成了难溶的有关 B、实验2比实验1现象更明显,可能是由于玻璃导管内空间狭小,热量不易散失 C、由实验1和实验3可得出“碱性增强有利于加快镁与水反应速率”的结论 D、实验3中破坏了在镁条表面的沉积,增大了镁与水的接触面积8. 废旧铅蓄电池会导致铅污染,RSR工艺回收铅的化工流程如图所示。
已知:ⅰ.铅膏的主要成分是和;是强酸;
ⅱ.、。
下列有关说法错误的是( )
A、步骤②中反应的化学平衡常数K约为 B、操作③需要用的玻璃仪器有烧杯、漏斗、玻璃棒 C、步骤④发生反应的离子方程式为 D、若步骤⑤用铅蓄电池作为电源电解溶液,当电路中有电子转移时,铅蓄电池负极质量的变化量与电解池阴极质量的变化量相等9. 一种以沸石笼为载体对NO进行催化还原的原理如图所示。下列说法错误的是( )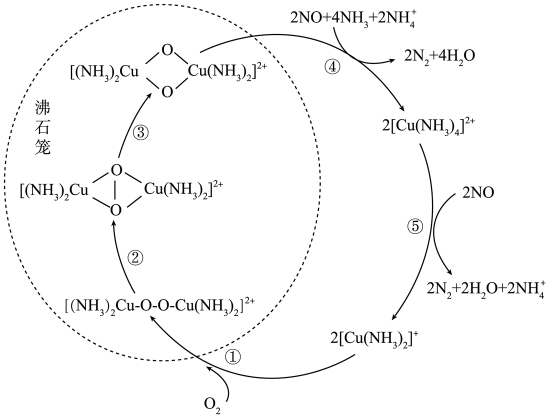 A、在催化还原过程中,起催化作用 B、在③的转化过程中,氧元素的化合价未发生变化 C、④涉及极性共价键的断裂与生成 D、图中总过程中每吸收需要消耗(标准状况)10. 实验室利用下图所示装置制备。已知:的沸点 , 易水解;在常压下沸点约(同时分解),易水解,可与氢氟酸反应制备。下列说法错误的是( )
A、在催化还原过程中,起催化作用 B、在③的转化过程中,氧元素的化合价未发生变化 C、④涉及极性共价键的断裂与生成 D、图中总过程中每吸收需要消耗(标准状况)10. 实验室利用下图所示装置制备。已知:的沸点 , 易水解;在常压下沸点约(同时分解),易水解,可与氢氟酸反应制备。下列说法错误的是( ) A、仪器Ⅰ中的a为冷凝水的进水口 B、仪器Ⅱ的主要作用是吸收和空气中的水蒸气 C、制备完成后,可减压蒸馏分离出 D、用制备时,可在玻璃仪器中进行11. 当氧化剂电对的电极电势大于还原剂电对的电极电势时,氧化还原反应才能进行。用如图所示装置探究原电池的工作原理,其中、均为碳棒,此时电流表的指针不发生偏转。已知:①反应中的两个电对的标准电极电势 , 。②标准电动势 , n为转移的电子数。下列说法错误的是( )
A、仪器Ⅰ中的a为冷凝水的进水口 B、仪器Ⅱ的主要作用是吸收和空气中的水蒸气 C、制备完成后,可减压蒸馏分离出 D、用制备时,可在玻璃仪器中进行11. 当氧化剂电对的电极电势大于还原剂电对的电极电势时,氧化还原反应才能进行。用如图所示装置探究原电池的工作原理,其中、均为碳棒,此时电流表的指针不发生偏转。已知:①反应中的两个电对的标准电极电势 , 。②标准电动势 , n为转移的电子数。下列说法错误的是( ) A、若向右侧烧杯中滴加浓盐酸,电流计指针会发生偏转 B、若向右侧烧杯中滴加溶液,此时电极的电极反应式为 C、向右侧烧杯中加入溶液时,盐桥中的阳离子向左侧烧杯移动 D、反应的12. 盐酸羟胺是一种常见的还原剂和显像剂,其化学性质与类似。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是( )
A、若向右侧烧杯中滴加浓盐酸,电流计指针会发生偏转 B、若向右侧烧杯中滴加溶液,此时电极的电极反应式为 C、向右侧烧杯中加入溶液时,盐桥中的阳离子向左侧烧杯移动 D、反应的12. 盐酸羟胺是一种常见的还原剂和显像剂,其化学性质与类似。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是( ) A、电池工作时,含Fe的催化电极作负极 B、图2中,M为和 , N为 C、电池工作时,每消耗(标准状况),左室溶液质量增加3.3g D、电池工作一段时间后,正极区溶液的减小、负极区溶液的增大13. 人体血液存在、等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值表示或与pH的关系如图所示。已知碳酸、磷酸。则下列说法正确的是 ( )
A、电池工作时,含Fe的催化电极作负极 B、图2中,M为和 , N为 C、电池工作时,每消耗(标准状况),左室溶液质量增加3.3g D、电池工作一段时间后,正极区溶液的减小、负极区溶液的增大13. 人体血液存在、等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值表示或与pH的关系如图所示。已知碳酸、磷酸。则下列说法正确的是 ( ) A、曲线Ⅰ表示与pH的变化关系 B、的过程中,水的电离程度逐渐减小 C、当时 D、当pH增大时,逐渐减小
A、曲线Ⅰ表示与pH的变化关系 B、的过程中,水的电离程度逐渐减小 C、当时 D、当pH增大时,逐渐减小二、多选题
-
14. 钴是一种重要的过渡金属元素,常见化合价有、价。实验室利用固体进行如下实验。下列说法错误的是( )
 A、Co在元素周期表中位于第四周期ⅧB族 B、固体Y为 C、酸性条件下氧化性: D、结合上述流程信息,若有与足量盐酸充分反应,理论上可以得到15. 有机物A存在如下转化关系,下列说法正确的是( )
A、Co在元素周期表中位于第四周期ⅧB族 B、固体Y为 C、酸性条件下氧化性: D、结合上述流程信息,若有与足量盐酸充分反应,理论上可以得到15. 有机物A存在如下转化关系,下列说法正确的是( )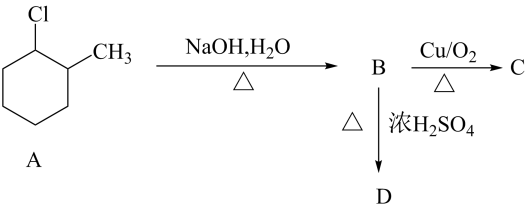 A、化合物A中含有2个手性碳原子 B、化合物B的同分异构体中,含有2个甲基、1个醛基的有6种 C、化合物C的核磁共振氢谱有五组峰 D、化合物D一定能通过加成反应得到化合物A
A、化合物A中含有2个手性碳原子 B、化合物B的同分异构体中,含有2个甲基、1个醛基的有6种 C、化合物C的核磁共振氢谱有五组峰 D、化合物D一定能通过加成反应得到化合物A三、非选择题
-
16. 过渡元素等在生产、生活和科研中都有着广泛用途和重要的研究价值。回答下列问题:(1)、基态Co原子中,核外电子占据的最高能层符号为;基态的价电子排布式为。(2)、Ag元素在元素周期表中与Cu处于相邻周期,则Ag元素在元素周期表分区中属于区。(3)、①有顺式和反式两种结构,则分子的空间构型为 (填“平面四方”或“正四面体”)形,其中心原子杂化方式推断合理的是(填标号)。
A.sp B. C. D.
②电子亲和能反映的是元素的气态原子结合电子的难易程度。N、Cl的第一电子亲和能:NCl(填“>”或“<”)。
(4)、熔点为 , 熔点为 , 熔点更高的原因是。(5)、一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为 , z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示;晶胞中碳原子的投影位置如图乙所示。
①该钛硅碳新型材料的化学式为。
②已知该新型材料的摩尔质量为 , 密度为 , 阿伏加德罗常数的值用表示,则c的长度为nm(用含a、b、的计算式表示)。
17. 五氧化二钒常用于生产硫酸或石油精炼的催化剂。某化工厂从废钒催化剂中(含有等)回收和 , 既能避免环境污染,又能节约资源。回收工艺流程如下:
已知:1:①"酸浸”时,和先与稀硫酸反应分别生成和;
②有机萃取剂萃取的能力比萃取的能力强;
③微溶于冷水、易溶于热水、难溶于乙醇;
④溶液中与可相互转化:。
回答下列问题:
(1)、滤渣2的成分主要有(填化学式)。(2)、“酸浸”时,参与反应的离子方程式为。(3)、“萃取”和“反萃取”时,将发生(其中R表示 , 表示有机萃取剂)。①“反萃取”操作加入的试剂是(填化学式)。
②假设“滤液2”中 , “萃取”和“反萃取”每进行一次,萃取率为90%,5次操作后,“滤液2”中残留的【萃取率=】。
(4)、“氧化”过程中发生反应的离子方程式为。(5)、①“沉钒”时生成 , 通入的作用是。②实验发现,温度超过以后沉钒率下降,可能的原因是。
18. 铋酸钠是一种新型的光催化剂。实验室利用如图所示装置制取铋酸钠(加热和夹持仪器已略去)。
已知:是难溶于水的白色固体;
②为浅黄色固体,不溶于冷水,在空气或热水中逐渐分解;
回答下列问题:
(1)、Ⅰ.制取酸钠检查装置气密性并加入试剂,装置丙中盛放固体与溶液的混合物,打开 , 向X中滴加浓盐酸。仪器X的名称为 , 丙中发生反应的离子方程式为。
(2)、装置乙的作用是。(3)、当丙中白色固体消失时,可以初步判断丙中反应已完成,此时应立即进行的操作是。(4)、Ⅱ.铋酸钠的分离提纯反应结束后,为从丙中获取粗产品,请从下列选项中选出最合理的操作(填标号)。
a.在冰水中冷却;b.用普通漏斗过滤;c.用布氏漏斗抽滤;d.冷水洗涤;e.热水洗涤;f.自然晾干;g.在干燥器中干燥
(5)、Ⅲ.铋酸钠的应用——检验往待检液中加入铋酸钠晶体,加硫酸酸化,生成 , 且溶液变为紫红色,证明待检液中存在。产生紫红色现象的离子方程式为。
(6)、Ⅳ.酸钠纯度的测定取上述制得的粗产品mg,加入足量的稀硫酸和稀溶液使其完全反应,再用的标准溶液滴定,滴定终点时消耗溶液。该产品的纯度是(用含n、m、V的代数式表示)。
19. 吲哚美辛片具有解热、镇痛以及抗炎等功效,下图为吲哚美辛的合成路线:
已知:①

②

③

回答下列问题:
(1)、A中含有的官能团的名称为 , B的结构简式为。(2)、C→D的化学方程式为 , 反应类型为。(3)、F的结构简式为。(4)、A的同分异构体中,与溶液发生显色反应的有种。(5)、根据题中信息,设计由苯胺和含有不超过2个碳原子的有机物为主要原料合成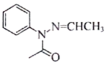 的合成路线。 20. 丙烯腈(
的合成路线。 20. 丙烯腈( )是一种重要的化工原料,广泛应用于三大有机合成材料的生产中。以
)是一种重要的化工原料,广泛应用于三大有机合成材料的生产中。以 为原料合成丙烯腈的主要反应如下:
为原料合成丙烯腈的主要反应如下:Ⅰ.
 (g)
(g) 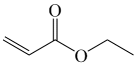 (g)+H2O(g) ∆H1>0
(g)+H2O(g) ∆H1>0Ⅱ.
 (g)+NH3(g)
(g)+NH3(g)  (g)+H2O(g)+
(g)+H2O(g)+  (g) ∆H2>0
(g) ∆H2>0回答下列问题:
(1)、已知部分化学键的键能如下表所示:化学键
键能()
351
348
615
413
463
745
据此计算。
(2)、在盛有催化剂、压强为的恒压密闭容器中按体积比2∶15充入 (g)和发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图1所示(例如
(g)和发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图1所示(例如 的物质的量分数ω%=
的物质的量分数ω%=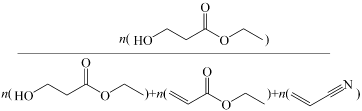 ×100%)。
×100%)。
①
 的名称为(用系统命名法命名)。
的名称为(用系统命名法命名)。②随着温度的升高,
 的平衡体积分数先增大后减小的原因为。
的平衡体积分数先增大后减小的原因为。③图中A点对应反应Ⅱ的标准平衡常数(保留两位有效数字)。【其表达式为用相对分压代替浓度平衡常数表达式中的浓度,气体的相对分压等于其分压(单位为)除以】
④实际生产中若充入一定量氨气可提高丙烯腈的平衡产率,原因为。
(3)、科学家通过DFT计算得出反应Ⅱ的机理如图2所示,其中第二步反应为 (g)
(g)  (g)+H2O(g),则第一步反应的化学方程式为。
(g)+H2O(g),则第一步反应的化学方程式为。 (4)、利用电解法由丙烯腈制备己二腈的装置如图3所示。
(4)、利用电解法由丙烯腈制备己二腈的装置如图3所示。
通电过程中,石墨电极2上的电极反应式为。