辽宁省沈阳市2022届高三教学质量监测(三)化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 下列说法中错误的是( )A、中国天眼FAST用到的碳化硅是一种新型的有机高分子材料 B、“蛟龙”号载人潜水器最关键的耐压球外壳由钛合金制造 C、“新冠疫情”医用防护服使用的聚氨酯薄膜是防水透湿功能高分子材料 D、嫦娥5号上携带的“高科技国旗”是以高性能芳纶纤维材料为主的复合材料2. 下列化学用语使用正确的是( )A、氯气的共价键电子云轮廓图:
 B、基态的价层电子排布图:
B、基态的价层电子排布图: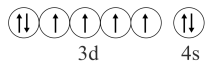 C、用电子式表示的形成过程:
C、用电子式表示的形成过程: D、的空间填充模型:
D、的空间填充模型: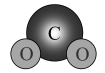 3. 下列说法中正确的是( )A、长期服用阿司匹林可预防某些疾病,无副作用 B、碳酸钠和碳酸氢钠均可做食品添加剂 C、煤的气化和液化都是物理变化 D、用清洁燃料天然气可减少温室效应4. 环丙贝特是一种降血脂药物。下图是合成环丙贝特的其中一步,下列说法中错误的是( )
3. 下列说法中正确的是( )A、长期服用阿司匹林可预防某些疾病,无副作用 B、碳酸钠和碳酸氢钠均可做食品添加剂 C、煤的气化和液化都是物理变化 D、用清洁燃料天然气可减少温室效应4. 环丙贝特是一种降血脂药物。下图是合成环丙贝特的其中一步,下列说法中错误的是( )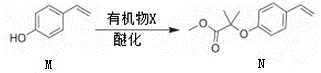 A、有机物x可能是
A、有机物x可能是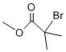 B、1molM与足量溴水反应最多消耗3mol溴单质
C、N分子最多有10个碳原子共面
D、M和N中都没有手性碳原子
5. 若NA是阿伏加德罗常数的值,下列说法中错误的是( )A、1mol2-甲基丁烷分子中含有的σ键数为16NA B、溶液中粒子数大于0.5NA C、30gHCHO与混合物中含C原子数为NA D、2.3gNa与完全反应,反应中转移的电子数介于0.1NA和0.2NA之间6. Molnupiravir(M)是全球首款治疗新型冠状病毒的口服小分子药物,它在体内代谢产物NHCtriphosphate(N)可引起新冠病毒RNA复制不符合题意,其代谢过程如图,下列说法中错误的是( )
B、1molM与足量溴水反应最多消耗3mol溴单质
C、N分子最多有10个碳原子共面
D、M和N中都没有手性碳原子
5. 若NA是阿伏加德罗常数的值,下列说法中错误的是( )A、1mol2-甲基丁烷分子中含有的σ键数为16NA B、溶液中粒子数大于0.5NA C、30gHCHO与混合物中含C原子数为NA D、2.3gNa与完全反应,反应中转移的电子数介于0.1NA和0.2NA之间6. Molnupiravir(M)是全球首款治疗新型冠状病毒的口服小分子药物,它在体内代谢产物NHCtriphosphate(N)可引起新冠病毒RNA复制不符合题意,其代谢过程如图,下列说法中错误的是( ) A、该反应类型属于取代反应 B、M在碱性条件下的水解产物之一为异丁酸钠 C、N分子中含有磷酸酐键,水解时可断裂,释放较多能量 D、1molN与足量的Na反应最多可生成3mol7. 某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。已知该晶体的密度为 , 阿伏加德罗常数的值为 , 下列说法中错误的是( )
A、该反应类型属于取代反应 B、M在碱性条件下的水解产物之一为异丁酸钠 C、N分子中含有磷酸酐键,水解时可断裂,释放较多能量 D、1molN与足量的Na反应最多可生成3mol7. 某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。已知该晶体的密度为 , 阿伏加德罗常数的值为 , 下列说法中错误的是( )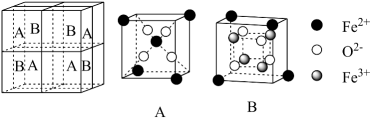 A、该铁的氧化物化学式为 B、距离Fe3+最近的有6个 C、晶体中的只能构成正四面体空隙 D、晶胞的边长为8. 下列实验现象及结论均正确的是( )
A、该铁的氧化物化学式为 B、距离Fe3+最近的有6个 C、晶体中的只能构成正四面体空隙 D、晶胞的边长为8. 下列实验现象及结论均正确的是( )选项
A
B
C
D
实验操作



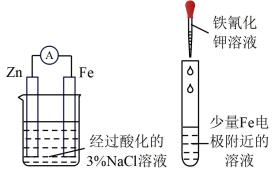
现象
a中产生白色沉淀
b中先产生白色沉淀,后沉淀溶解
热水浴中的试管中先出现浑浊
酸性高锰酸钾溶液褪色
试管中有蓝色沉淀产生
结论
金属性:Mg>Al
其他条件不变时,温度升高,化学反应速率加快
乙醇与浓硫酸混合加热至170℃,有乙烯生成
Fe电极被保护
A、A B、B C、C D、D9. 下列离子方程式中错误的是( )A、第一步水解: B、硫代硫酸钠溶液中通入: C、氯化银加入硫代硫酸钠溶液后溶解: D、苯酚钠溶液中通少量:10. 镁-锂双离子二次电池的装置如图所示,下列说法中错误的是( ) A、放电时,Mg为负极 B、充电时每转移1mol电子,左侧电解质溶液质量减少5g C、充电时,阳极的电极反应式为 D、电池工作时发挥了镁离子和锂离子电池的性能优势,并减少了锂资源的应用11. 在298K、101kPa下,合成氨反应的能量变化图如图所示(图中“吸”表示在催化剂表面的吸附)。下列说法中正确的是( )
A、放电时,Mg为负极 B、充电时每转移1mol电子,左侧电解质溶液质量减少5g C、充电时,阳极的电极反应式为 D、电池工作时发挥了镁离子和锂离子电池的性能优势,并减少了锂资源的应用11. 在298K、101kPa下,合成氨反应的能量变化图如图所示(图中“吸”表示在催化剂表面的吸附)。下列说法中正确的是( ) A、图中决速步骤的反应方程式为 B、该历程中最大能垒(活化能)E=295kJ/mol C、合成氨工业中采用循环操作,主要目的是增大化学反应速率 D、该反应为放热反应,所以反应中温度越低越好12. 弱酸型指示剂的电离平衡可表示为: , 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )
A、图中决速步骤的反应方程式为 B、该历程中最大能垒(活化能)E=295kJ/mol C、合成氨工业中采用循环操作,主要目的是增大化学反应速率 D、该反应为放热反应,所以反应中温度越低越好12. 弱酸型指示剂的电离平衡可表示为: , 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )
(图中环状结构为苯环)
A、pH改变时,酸碱指示剂的分子、离子相对含量变化引起溶液颜色变化 B、溶液从酸性到强碱性的过程中,酚酞中的碳原子a从杂化转化为杂化 C、当指示剂的 , 则 , 此时的pH为理论变色点 D、温度改变,指示剂的变色范围可能发生改变13. 双极膜在直流电场的作用下,能将水解离为和OH- , 并实现其定向通过。将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜间的电渗析室可得到缩水甘油。下列说法中错误的是( ) A、装置工作时,电渗析室发生的反应
A、装置工作时,电渗析室发生的反应 →
→ +HCl是氧化反应
B、通电前后,电渗析室内溶液的pH几乎不变
C、Cl—从电渗析室通过阴离子交换膜M迁移到阳极
D、反应生成1mol缩水甘油转移1mol电子
14. 由化合物甲和乙低温共熔的电解液可作为高能电池材料,其结构如图,它们的构成元素R、W、X、Y、Z、M原子序数依次增大且总和为42,下列说法中错误的是( )
+HCl是氧化反应
B、通电前后,电渗析室内溶液的pH几乎不变
C、Cl—从电渗析室通过阴离子交换膜M迁移到阳极
D、反应生成1mol缩水甘油转移1mol电子
14. 由化合物甲和乙低温共熔的电解液可作为高能电池材料,其结构如图,它们的构成元素R、W、X、Y、Z、M原子序数依次增大且总和为42,下列说法中错误的是( ) A、元素Z、Y均能与R形成含有非极性键的18电子化合物 B、第一电离能:Z>Y>X>W C、乙的沸点比丙酮高 D、甲中∠ZMZ比乙中∠ZXY小15. 为二元弱酸, , , , 向20mL0.1mol/L溶液中滴加0.2mol/LKOH溶液,溶液中含碳微粒的存在形式与物质的量百分比随KOH溶液体积变化如图所示,下列说法中错误的是( )
A、元素Z、Y均能与R形成含有非极性键的18电子化合物 B、第一电离能:Z>Y>X>W C、乙的沸点比丙酮高 D、甲中∠ZMZ比乙中∠ZXY小15. 为二元弱酸, , , , 向20mL0.1mol/L溶液中滴加0.2mol/LKOH溶液,溶液中含碳微粒的存在形式与物质的量百分比随KOH溶液体积变化如图所示,下列说法中错误的是( ) A、当时,混合溶液pH≈4.2 B、滴入10mLKOH溶液时,溶液呈酸性 C、滴入20mLKOH溶液时,溶液中 D、滴入KOH溶液的过程中,可能出现
A、当时,混合溶液pH≈4.2 B、滴入10mLKOH溶液时,溶液呈酸性 C、滴入20mLKOH溶液时,溶液中 D、滴入KOH溶液的过程中,可能出现二、综合题
-
16. 七钼酸铵[]在超导、激光等高科技领域中发挥着重要作用。由钼焙砂(主要成分为、 , 含有CuO、、等杂质)制备七钼酸铵的工艺流程如图所示。

请回答下列问题:
(1)、的价电子排布式为。(2)、“酸洗”时被稀氧化为和 , 该反应的离子方程式为;酸洗加入硝酸铵的目的,除提供反应需要的外,其主要作用是。(3)、“净化”步骤的目的是进一步除去少量残留的 , 若试剂X为FeS,反应的离子方程式为;该反应的平衡常数值为。[已知: , ]
(4)、酸沉结晶后得到的母液经处理后可返回工序继续使用。(5)、四钼酸铵溶于氨水中后通过降温结晶的方式得到七钼酸铵。由下图可知,应选用最佳结晶条件为。

 (6)、某工厂用钼焙砂(含、)制备 , 最终得到产品 , 产率为(写出表达式)。17. 目前,汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应:(1)、已知:①
(6)、某工厂用钼焙砂(含、)制备 , 最终得到产品 , 产率为(写出表达式)。17. 目前,汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应:(1)、已知:①②
则kJ/mol。
(2)、将CO和NO以一定流速通过两种不同的催化剂发生反应 , 相同时间内测量逸出气体中的含量,从而确定尾气脱氮率(即NO的转化率),结果下图所示。
①a点的b点的(填“>”“<”或“=”)。
②c点(填“是”或“否”)一定是平衡状态,理由是。
③研究表明氧气的存在对于NO的还原有抑制作用,原因是。
(3)、对于反应 , 实验测得: , , 、分别是正、逆反应速率常数,且只是温度的函数。下列说法中正确的是____。A、反应余热可以进入温差发电器为电能汽车提供动力 B、使用不同的催化剂反应的活化能随之改变 C、其他条件不变,随1/T增大而增大(4)、T℃,将2molNO(g)和2molCO(g)通入体积为1L的恒容密闭容器发生上述反应,时达到平衡,测得反应过程中CO的转化率与时间的关系如下图,则a点处对应的。 18. 过氧化锶可作为曳光弹、焰火的引火剂,亦用于漂白、制药行业。是一种白色粉末,加热条件下可与、水蒸气反应,室温时在水中逐渐形成无色晶体 , 遇酸能生成过氧化氢。(1)、实验室利用锶单质制备过氧化锶可能用到的仪器如下:
18. 过氧化锶可作为曳光弹、焰火的引火剂,亦用于漂白、制药行业。是一种白色粉末,加热条件下可与、水蒸气反应,室温时在水中逐渐形成无色晶体 , 遇酸能生成过氧化氢。(1)、实验室利用锶单质制备过氧化锶可能用到的仪器如下:
①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→。(选择必要的仪器,可重复选择)
②在空气中会变质生成碳酸盐,写出该反应的化学方程式。
(2)、通入氨气的条件下,在水溶液中可制备得到 , 实验装置如下:
仪器a的名称为 , 装置乙的作用为。
(3)、装置丙中制备的离子方程式 , 的作用是。(4)、为测定样品的纯度,可进行下列实验:准确称取2.0g样品置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用0.8000mol/L标准溶液滴定至溶液蓝色恰好消失,记下此时消耗标准溶液的体积,重复实验3~4次,得下表数据:平行实验
1
2
3
4
消耗标准溶液体积(mL)
14.98
14.50
15.00
15.02
样品的纯度为。(已知:)
19. 凡德他尼J是一种具有口服活性的低分子多靶点抗癌药物,其合成路线如下: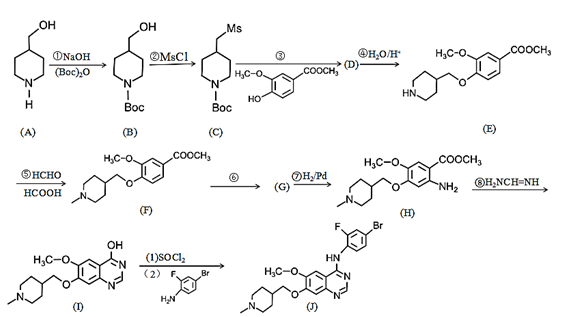
已知:-Boc代表叔丁氧羰基:。
请回答下列问题:
(1)、E中含氧官能团的名称为 , D的结构简式为。(2)、①、⑦的反应类型分别是 , 。(3)、反应④在室温下进行,写出除E外的含有碳元素的主要产物。(4)、设计①和④的目的是。(5)、已知G的分子式是 , 请写出反应⑥的化学方程式为。(6)、已知M是 的同系物,M比它的相对分子质量大14,有四个取代基,且含有
的同系物,M比它的相对分子质量大14,有四个取代基,且含有 结构,满足以上条件的M的结构有种。(不考虑立体异构)
结构,满足以上条件的M的结构有种。(不考虑立体异构)