江苏省泰州市2021-2022学年高三下学期第四次调研测试化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 乙醚、75%乙醇、过氧乙酸(CH3COOOH)、氯仿等化学药品均可有效灭活新冠病毒。下列说法正确的是( )A、乙醚可由2分子乙醇脱水制得 B、乙醇通过氧化灭活病毒 C、过氧乙酸中O原子均为-2价 D、氯仿的化学名称是二氯甲烷2. 硼酸和乙醇可以发生酯化反应:B(OH)3+3C2H5OH (C2H5O)3B+3H2O。生成的硼酸三乙酯点燃时产生绿色火焰,可通过该现象鉴定硼酸,下列表示正确的是( )A、中子数为8的O原子: B、乙醇分子的比例模型:
 C、基态C原子核外价电子的轨道表达式:
C、基态C原子核外价电子的轨道表达式: D、硼酸在水中的电离方程式:B(OH)3+H2O=B(OH)+H+
3. 下列有关物质的性质与用途不具有对应关系的是( )A、硫酸亚铁水溶液呈弱酸性,可用作食品抗氧化剂 B、小苏打水溶液呈弱碱性,可用作制药中的抗酸剂 C、氨气具有还原性,可用作烟气中NOx脱除 D、漂白粉具有强氧化性,可用作游泳池的杀菌消毒剂4. 催化剂作用下,SO2与Cl2反应生成SO2Cl2;对SO2水溶液的光谱分析可以检测到、和痕量的 , 三氧化硫在液态时有单分子SO3和三聚的(SO3)3(结构如下图所示)两种形式,在高温时能将HBr氧化为Br2。关于说法正确的是( )
D、硼酸在水中的电离方程式:B(OH)3+H2O=B(OH)+H+
3. 下列有关物质的性质与用途不具有对应关系的是( )A、硫酸亚铁水溶液呈弱酸性,可用作食品抗氧化剂 B、小苏打水溶液呈弱碱性,可用作制药中的抗酸剂 C、氨气具有还原性,可用作烟气中NOx脱除 D、漂白粉具有强氧化性,可用作游泳池的杀菌消毒剂4. 催化剂作用下,SO2与Cl2反应生成SO2Cl2;对SO2水溶液的光谱分析可以检测到、和痕量的 , 三氧化硫在液态时有单分子SO3和三聚的(SO3)3(结构如下图所示)两种形式,在高温时能将HBr氧化为Br2。关于说法正确的是( ) A、SO2、SO3都是非极性分子 B、SO2Cl2为正四面体结构 C、SO3、中S原子都是sp2杂化 D、1 mol (SO3)3分子中含有12 mol σ键5. 在指定条件下,下列选项所示的物质间的转化能够实现的是( )A、 B、 C、 D、6. SO2转化为SO3的反应为2SO2(g)+O2(g)=2SO3(g) △H=-197.7kJ·mol-1 , 对于反应2SO2(g)+O2(g)2SO3(g),下列说法正确的是( )A、升高温度,能增加SO2的反应速率和转化率 B、使用催化剂,能改变反应路径并降低反应活化能 C、工业上不采用高压条件,是因为加压会降低SO2的平衡转化率 D、单位时间内生成2molSO2、同时消耗2moSO3 , 则反应处于平衡状态7. 我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素W、X、Y、Z。已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8。下列说法正确的是( )A、离子半径:Z>Y>W>X B、同周期第一电离能小于Z的元素有4种 C、X与Y可形成共价化合物YX2 D、简单氢化物的还原性:W的氢化物>Z的氢化物8. 化合物Z是合成用于降低体重、缩小腰围药物利莫那班的重要中间体。
A、SO2、SO3都是非极性分子 B、SO2Cl2为正四面体结构 C、SO3、中S原子都是sp2杂化 D、1 mol (SO3)3分子中含有12 mol σ键5. 在指定条件下,下列选项所示的物质间的转化能够实现的是( )A、 B、 C、 D、6. SO2转化为SO3的反应为2SO2(g)+O2(g)=2SO3(g) △H=-197.7kJ·mol-1 , 对于反应2SO2(g)+O2(g)2SO3(g),下列说法正确的是( )A、升高温度,能增加SO2的反应速率和转化率 B、使用催化剂,能改变反应路径并降低反应活化能 C、工业上不采用高压条件,是因为加压会降低SO2的平衡转化率 D、单位时间内生成2molSO2、同时消耗2moSO3 , 则反应处于平衡状态7. 我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素W、X、Y、Z。已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8。下列说法正确的是( )A、离子半径:Z>Y>W>X B、同周期第一电离能小于Z的元素有4种 C、X与Y可形成共价化合物YX2 D、简单氢化物的还原性:W的氢化物>Z的氢化物8. 化合物Z是合成用于降低体重、缩小腰围药物利莫那班的重要中间体。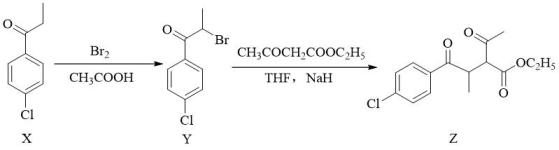
下列有关X、Y、Z的说法错误的是( )
A、X→Y、Y→Z都是取代反应 B、X分子中所有碳原子可能在同一平面上 C、Y在浓硫酸催化下加热可发生消去反应 D、Z与足量NaOH溶液反应最多消耗3mol NaOH9. 某化学兴趣小组以含钴废渣(主要成分CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备Co2O3的一种实验流程如下。下列与流程相关的原理、装置和操作能达到实验目的的是( )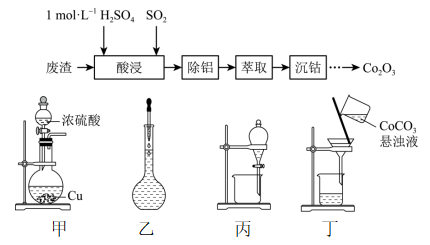 A、“酸浸”中的SO2作还原剂,用装置甲制取 B、“酸浸”所需的250 mL 1.0 mol·L-1 H2SO4溶液用装置乙配制 C、“萃取”的目的是除去Zn2+ , 用装置丙,振荡时分液漏斗下端应向下倾斜 D、“沉钴”时向萃取液中缓慢滴加沉淀剂,用装置丁过滤所得悬浊液10. CO2催化加氢制备甲醇的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49 kJ·mol-1 , CO2电化学还原法制备甲醇的电解原理如图所示。下列说法错误的是( )
A、“酸浸”中的SO2作还原剂,用装置甲制取 B、“酸浸”所需的250 mL 1.0 mol·L-1 H2SO4溶液用装置乙配制 C、“萃取”的目的是除去Zn2+ , 用装置丙,振荡时分液漏斗下端应向下倾斜 D、“沉钴”时向萃取液中缓慢滴加沉淀剂,用装置丁过滤所得悬浊液10. CO2催化加氢制备甲醇的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49 kJ·mol-1 , CO2电化学还原法制备甲醇的电解原理如图所示。下列说法错误的是( ) A、CO2催化加氢法在低温自发时△H的影响为主 B、a膜为阴离子交换膜,石墨电极上的电极反应式为4OH--4e-=2H2O+O2↑ C、电解过程中,右室溶液中物质的量减小 D、产生相同量CH3OH时,催化加氢法消耗的H2与电化学还原法产生的O2物质的量之比为2:111. (CH3NH3)PbI3是钙钛矿太阳能电池的重要吸光材料,其晶胞结构如图1所示,Walsh提出H2O降解(CH3NH3)PbI3的机理如图2所示。
A、CO2催化加氢法在低温自发时△H的影响为主 B、a膜为阴离子交换膜,石墨电极上的电极反应式为4OH--4e-=2H2O+O2↑ C、电解过程中,右室溶液中物质的量减小 D、产生相同量CH3OH时,催化加氢法消耗的H2与电化学还原法产生的O2物质的量之比为2:111. (CH3NH3)PbI3是钙钛矿太阳能电池的重要吸光材料,其晶胞结构如图1所示,Walsh提出H2O降解(CH3NH3)PbI3的机理如图2所示。
下列说法错误的是( )
A、H3O+的键角小于H2O的键角 B、1个(CH3NH3)PbI3晶胞含有3个I- C、机理中的反应均为非氧化还原反应 D、H2O可与CH3NH反应生成H3O+和CH3NH212. 常温下,Ka1(H2C2O4)=10-1.26、Ka2(H2C2O4)=10-4.27、Ksp(CaC2O4)=10-8.64 , 实验室进行多组实验测定某些酸、碱、盐性质,相关实验记录如表:实验
实验操作和现象
1
常温下,向4 mL 0.01 mol·L-1的KMnO4酸性溶液中加入2 mL 0.10 mol·L-1H2C2O4溶液,溶液褪色
2
常温下,测得0.10 mol·L-1NaHC2O4溶液的pH=a
3
常温下,向0.10 mol·L-1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10-4 mol·L-1
4
常温下,向0.10 mol·L-1Na2C2O4溶液中滴加等浓度盐酸至溶液的pH=7
下列所得结论正确的是( )
A、实验1中H2C2O4溶液具有漂白性 B、实验2中a>7 C、实验3清液中c(HC2O)=10-4.37 mol·L-1 D、实验4溶液中c(Cl-)=c(H2C2O4)+c(HC2O)13. CH4—CO2重整反应能够有效去除大气中 CO2 , 是实现“碳中和”的重要途径之一,发生的反应如下:重整反应 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH
积炭反应Ⅰ 2CO(g)=CO2(g)+C(s) ΔH1=―172 kJ·mol-1
积炭反应Ⅱ CH4(g)=C(s)+2H2(g) ΔH2=+75kJ·mol-1
在恒压、起始投料比=1条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是( )
 A、重整反应的反应热ΔH=-247 kJ·mol-1 B、曲线B表示CH4平衡时物质的量随温度的变化 C、积炭会导致催化剂失活,降低CH4的平衡转化率 D、低于600℃时,降低温度有利于减少积炭的量并去除CO2气体
A、重整反应的反应热ΔH=-247 kJ·mol-1 B、曲线B表示CH4平衡时物质的量随温度的变化 C、积炭会导致催化剂失活,降低CH4的平衡转化率 D、低于600℃时,降低温度有利于减少积炭的量并去除CO2气体二、综合题
-
14. K2Cr2O7是化学实验室中的一种重要分析试剂。工业上以铬铁矿[Fe(CrO2) 2 , 含Al、Si氧化物等杂质]为主要原料制备K2Cr2O7的工艺流程如图所示。
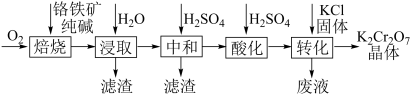 (1)、“焙烧”过程。将一定量铬铁矿与Na2CO3固体混合后在空气中焙烧,生成Na2CrO4和Fe2O3 , 该反应的化学方程式为。(2)、“转化”过程。如图为几种物质在水中的溶解度随温度变化曲线。向酸化液中加入一定量KCl固体,并将溶液蒸发浓缩至有晶膜出现,降温时会析出大量K2Cr2O7晶体,试分析晶体析出的原理。
(1)、“焙烧”过程。将一定量铬铁矿与Na2CO3固体混合后在空气中焙烧,生成Na2CrO4和Fe2O3 , 该反应的化学方程式为。(2)、“转化”过程。如图为几种物质在水中的溶解度随温度变化曲线。向酸化液中加入一定量KCl固体,并将溶液蒸发浓缩至有晶膜出现,降温时会析出大量K2Cr2O7晶体,试分析晶体析出的原理。 (3)、生产过程中产生的K2Cr2O7酸性废液可通过以下方法处理。
(3)、生产过程中产生的K2Cr2O7酸性废液可通过以下方法处理。①钡盐沉淀法。先将K2Cr2O7酸性废液碱化处理,再加入BaCl2.废液需进行碱化处理的目的是。[已知:BaCrO4(s)Ba2+(aq)+ CrO(aq) ΔH>0;Ksp(BaCrO4)=1.2×10-10]
②FeS还原法。在K2Cr2O7酸性废液中加入纳米FeS后,测得Cr(Ⅵ)和总铬去除率随时间的变化关系如图所示,反应过程中还检测到Cr2S3沉淀。10 min后,Cr(Ⅵ)和总铬的去除率升高幅度变小的可能原因是。
 (4)、测定K2Cr2O7产品纯度。称取产品2.500 g配成500 mL溶液,取25.00 mL于锥形瓶中,加10 mL 2 mol·L-1H2SO4和足量KI,放于暗处5 min (+I-→I2+Cr3+)。然后加入100 mL水,加入3 mL淀粉溶液,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+→I-+),消耗20.00 mLNa2S2O3标准溶液,则该样品的纯度为。(写出计算过程)15. 化合物G为一种促进睡眠的药物,其部分合成路线如下:
(4)、测定K2Cr2O7产品纯度。称取产品2.500 g配成500 mL溶液,取25.00 mL于锥形瓶中,加10 mL 2 mol·L-1H2SO4和足量KI,放于暗处5 min (+I-→I2+Cr3+)。然后加入100 mL水,加入3 mL淀粉溶液,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+→I-+),消耗20.00 mLNa2S2O3标准溶液,则该样品的纯度为。(写出计算过程)15. 化合物G为一种促进睡眠的药物,其部分合成路线如下: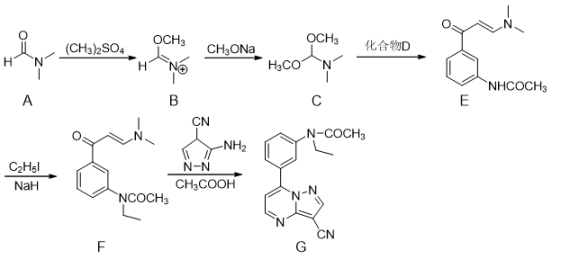 (1)、A能与以任意比水混溶,原因是该分子为极性分子且。(2)、A转化为B需经历A→X→B,中间体X的结构简式为
(1)、A能与以任意比水混溶,原因是该分子为极性分子且。(2)、A转化为B需经历A→X→B,中间体X的结构简式为 , 则X→B的反应类型为。 (3)、由C和D转化为E的过程中,还生成2分子的甲醇,则化合物D(C10H11NO2)的结构简式为。(4)、F经水解并还原得到的一种产物为H(C11H15NO),写出满足下列条件的H的同分异构体的结构简式。
, 则X→B的反应类型为。 (3)、由C和D转化为E的过程中,还生成2分子的甲醇,则化合物D(C10H11NO2)的结构简式为。(4)、F经水解并还原得到的一种产物为H(C11H15NO),写出满足下列条件的H的同分异构体的结构简式。①苯环上有4个取代基;②能发生银镜反应,存在4种不同化学环境的氢原子。
(5)、已知: 。写出以苯酚和碘甲烷为原料制备
。写出以苯酚和碘甲烷为原料制备 的合成路线流程图。(无机试剂任用,合成路线流程图见本题题干) 16. 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种肠溶性饲料添加剂。某化学实验小组利用FeCO3与甘氨酸反应制备(NH2CH2COO)2Fe,实验过程如下:
的合成路线流程图。(无机试剂任用,合成路线流程图见本题题干) 16. 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种肠溶性饲料添加剂。某化学实验小组利用FeCO3与甘氨酸反应制备(NH2CH2COO)2Fe,实验过程如下:步骤Ⅰ:将足量废铁屑和 1.0 mol·L-1硫酸充分反应后,再与1.0 mol·L-1NH4HCO3溶液混合,装置如图1,反应结束后过滤并洗涤得FeCO3
步骤Ⅱ :将FeCO3溶于甘氨酸和柠檬酸的混合溶液,生成(NH2CH2COO)2Fe.当溶液中Fe(Ⅱ)浓度为0.5 mol·L-1时,(NH2CH2COO)2Fe产率随溶液pH的变化如图2所示。
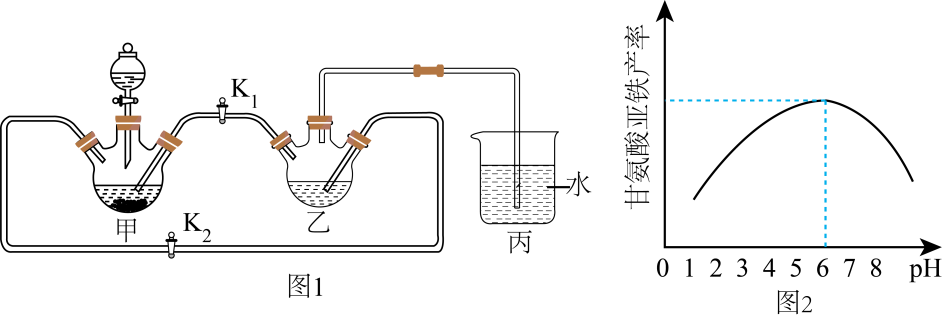
已知:①甘氨酸亚铁易溶于水,难溶于酒精;②甘氨酸具有两性,易溶于水;③柠檬酸易溶于水和酒精,具有强酸性和强还原性。
(1)、连接好装置,检查装置气密性的方法是。(2)、乙中发生反应的离子方程式为。实验中不能用1.0 mol·L-1NaHCO3溶液代替1.0 mol·L-1NH4HCO3溶液的可能原因是。(3)、柠檬酸的作用是。(4)、步骤Ⅱ具体操作:取0.10mol步骤I得到的沉淀置于反应容器内, , 使得Fe(Ⅱ)浓度约为0.5 mol·L-1 , , 用乙醇洗涤,干燥得到甘氨酸亚铁。(须使用的仪器和试剂:pH计、1.0mol·L-1甘氨酸溶液、柠檬酸、0.1 mol·L-1NaOH溶液、乙醇)17. 纳米零价铁(ZVI)因其高比表面积、优异的吸附性、较强的还原性和反应活性等优点被广泛应用于污染物的去除。(1)、ZVI可通过FeCl2·4H2O和NaBH4溶液反应制得,同时生成H2、B(OH) , 制备过程中需要不断通入高纯氮气,其目的是。(2)、ZVI电化学腐蚀处理三氯乙烯进行水体修复,H+、O2、等物种的存在会影响效果,水体修复的过程如图所示。有效腐蚀过程中,生成1mol乙烯所转移的电子物质的量为mol,过程④对应的电极反应式为。 (3)、ZVI可去除废水中Pb2+ , pH<6时,pH对Pb2+的去除率的影响如图所示。
(3)、ZVI可去除废水中Pb2+ , pH<6时,pH对Pb2+的去除率的影响如图所示。
已知:ⅰ)在水中,ZVI表面的FeOH会因为质子化/去质子化作用而使其表面带正/负电荷,可表示为:FeOH+H+FeOH , FeOHFeO-+H+。pH约为8.1达到等电点,ZVI表面不带电。
ⅱ)pH<6时,ZVI去除Pb2+主要发生表面配位反应和还原反应:
2FeOH+ Pb2+(FeO)2Pb + 4H+
2Fe+ 3Pb2++ 4H2O3Pb+2FeOOH + 6H+
①pH<6时,铁氧化物颗粒不易吸附Pb2+的原因是。
②pH<6时,随着pH增大,Pb2+的去除率会增大至接近100%的原因是。
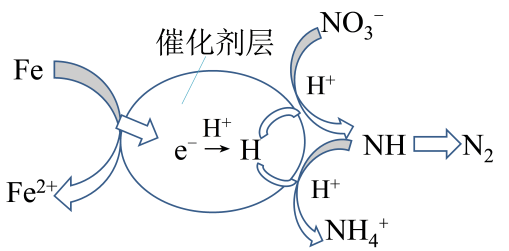
(4)、催化剂协同ZVI能将水体中的硝酸盐()转化为N2 , 其催化还原反应的过程如图所示。为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当pH<4.2时,随pH减小,N2生成率逐渐降低的原因是。