河南省名校联盟2022届高三下学期5月大联考理科综合化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 2022年北京冬奥会采用绿电制绿氢技术,即用光伏、风能等产生绿电,绿电电解水制得的氢气叫绿氢,实现碳的零排放。下列有关说法正确的是( )A、光伏电池能将太阳能全部转化成电能 B、绿氢在阴极上产生 C、常加入食盐增强水的导电性 D、阳极上发生还原反应2. 科学家找到了大脑进入“梦乡”的钥匙——多巴胺(DA),DA的结构简式如图。下列关于DA的说法正确的是( )
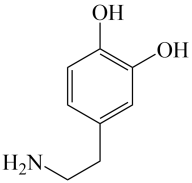 A、分子式为 B、分子中所有原子位于同一平面 C、能发生加成反应和消去反应 D、一氯代物只有3种3. 碘仿(CHI3)是一种外用消毒剂。某实验小组通过电解KI和丙酮(CH3COCH3)来制备碘仿。制得的粗碘仿中含少量石墨粉,分离提纯碘仿的操作中,下列仪器没有用到的是( )
A、分子式为 B、分子中所有原子位于同一平面 C、能发生加成反应和消去反应 D、一氯代物只有3种3. 碘仿(CHI3)是一种外用消毒剂。某实验小组通过电解KI和丙酮(CH3COCH3)来制备碘仿。制得的粗碘仿中含少量石墨粉,分离提纯碘仿的操作中,下列仪器没有用到的是( )已知几种物质的部分性质如表所示:
物质
熔点/℃
沸点/℃
溶解性
丙酮
-95
56
与水、乙醇互溶
碘仿
123
218
不溶于水,溶于热乙醇
A、 B、
B、 C、
C、 D、
D、 4. 设NA为阿伏加德罗常数的值。下列说法 正确的是( )A、44.8 L丙烯和44.8 L丙烷中含有的碳原子数均为6NA B、将1mol明矾完全溶于水,所得溶液中阴离子总数小于2NA C、12.8g铜完全溶于未知浓度的硝酸中,转移的电子数为0.4NA D、1 mol苯乙烯(
4. 设NA为阿伏加德罗常数的值。下列说法 正确的是( )A、44.8 L丙烯和44.8 L丙烷中含有的碳原子数均为6NA B、将1mol明矾完全溶于水,所得溶液中阴离子总数小于2NA C、12.8g铜完全溶于未知浓度的硝酸中,转移的电子数为0.4NA D、1 mol苯乙烯( )与足量H2在催化剂和加热条件下反应,形成C- H键的数目最多为2 NA
5. A、B、D、E是原子序数依次增大的短周期主族元素,其中D元素是地壳中含量最高的金属元素,E元素的单质常用来制造太阳能电池,A3B+和BA-含有相同的电子数。下列说法错误的是( )A、最简单氢化物的稳定性:E>B B、原子半径:D>E>B>A C、A,B组成的化合物A2B2是一种绿色氧化剂 D、含E的一种盐溶液常用作木材防火剂6. 我国科学家研发出一种绿色锌碘单液流二次电池,工作原理如图所示。下列说法错误的是( )
)与足量H2在催化剂和加热条件下反应,形成C- H键的数目最多为2 NA
5. A、B、D、E是原子序数依次增大的短周期主族元素,其中D元素是地壳中含量最高的金属元素,E元素的单质常用来制造太阳能电池,A3B+和BA-含有相同的电子数。下列说法错误的是( )A、最简单氢化物的稳定性:E>B B、原子半径:D>E>B>A C、A,B组成的化合物A2B2是一种绿色氧化剂 D、含E的一种盐溶液常用作木材防火剂6. 我国科学家研发出一种绿色锌碘单液流二次电池,工作原理如图所示。下列说法错误的是( ) A、放电时,聚烯烃多孔电极上发生氧化反应 B、放电时,K+向多孔石墨电极迁移 C、充电时,阳极反应式为2I--2e-=I2 D、充电时,阴极净增65g时a区净增2mol离子7. 常温常压下,将等浓度溶液分别滴加到相同、等体积的溶液和溶液中,溶液的与粒子浓度比值的对数关系如图所示。下列说法错误的是( )
A、放电时,聚烯烃多孔电极上发生氧化反应 B、放电时,K+向多孔石墨电极迁移 C、充电时,阳极反应式为2I--2e-=I2 D、充电时,阴极净增65g时a区净增2mol离子7. 常温常压下,将等浓度溶液分别滴加到相同、等体积的溶液和溶液中,溶液的与粒子浓度比值的对数关系如图所示。下列说法错误的是( )已知: , ,
 A、N表示溶液的与的变化关系 B、b点,溶液中由水电离出的约为 C、a点溶液中的数目大于其中含有的酸分子的数目 D、向溶液中滴加溶液至 ,
A、N表示溶液的与的变化关系 B、b点,溶液中由水电离出的约为 C、a点溶液中的数目大于其中含有的酸分子的数目 D、向溶液中滴加溶液至 ,二、综合题
-
8. 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2 , 还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题:
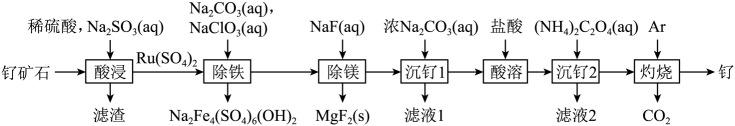 (1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。
(1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。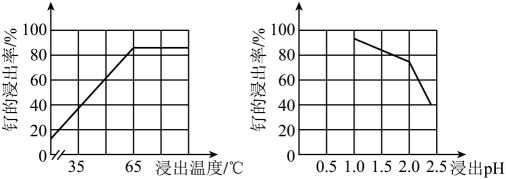 (3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)9. 苯硫酚 是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示:
(3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)9. 苯硫酚 是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示:物质
化学式
相对分子质量
熔点/
沸点/
相对密度
溶解性
苯硫酚
110
169.5
1.07
难溶于水
苯磺酰氯
176.5
14.5
251
1.38
难溶于水
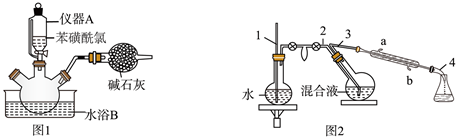
操作步骤:
①向三口烧瓶中加入 冰和 浓硫酸。
②再向三口烧瓶中慢慢加入 苯磺酰氯,尽快地分次加入 锌粉,继续反应 ,温度保持在 左右,如图1。
③撤去水浴B,微热三口烧瓶,并保持一定的回流。反应平稳后,再加热 。
④将反应后的混合液进行水蒸气蒸馏,分出苯硫酚,如图2。
⑤加入氯化钙,经操作X得粗品 。再进行蒸馏,收集馏分,得纯品 。
回答下列问题:
(1)、仪器A的名称是。(2)、已知:在水中加入盐,水的沸点会升高,凝固点会降低。水浴B应选择(填标号)。a.冰盐水浴 b.冷水浴 c.热水浴
(3)、在水蒸气蒸馏中(如图2),导管1的作用是 , 冷凝管中冷却水从(填“a”或“b”,下同)口进、口出。(4)、步骤⑤中操作X是。蒸馏时,收集馏分时温度计的读数为 。(5)、本实验中,苯硫酚的产率约为(保留整数) 。(6)、取少量苯硫酚产品于酸性 溶液中,振荡,溶液褪色,说明苯硫酚具有(填“氧化”或“还原”)性。10. 我国科学家利用钴分子筛实现丙烯高选择性合成甲基环氧乙烷():主反应:(g,甲基环氧乙烷)
副反应:(g,丙醛) (a、b都大于0)
请回答下列问题:
(1)、(g,甲基环氧乙烷)(g,丙醛) 。(2)、一定温度下,在恒容密闭容器中充入和 , 同时发生上述两个反应,下列表明反应已达到平衡状态的是____(填标号)。A、混合气体的密度不随时间变化 B、混合气体的总压强不随时间变化 C、混合气体的平均摩尔质量不随时间变化 D、消耗丙烯的速率等于消耗O2速率的2倍(3)、在恒容密闭容器中充人一定量丙烯和氧气,在不同催化剂Cat1、Cat2条件下发生反应(g,甲基环氧乙烷),测得单位时间内丙烯转化率与温度的关系如图1。①相对催化效率较大的催化剂是(填“Cat1”或“Cat2”)。
②在Cat1催化下,300℃时对应的状态(填“是”或“不是”)平衡状态,判断的依据是。
③在Cat1催化下,温度高于300℃时丙烯转化率急剧下降的主要原因可能是。(答一条即可)
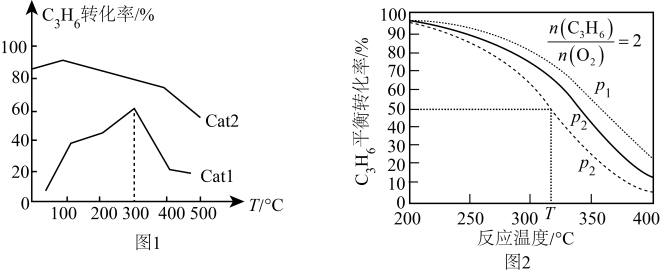 (4)、在一密闭容器中充入2mol丙烯和xmol , 同时发生上述两个反应,测得丙烯平衡转化率与温度、压强的关系如图2。
(4)、在一密闭容器中充入2mol丙烯和xmol , 同时发生上述两个反应,测得丙烯平衡转化率与温度、压强的关系如图2。①其他条件相同,p1、p2、p3由大到小的顺序为。
②在p3、T℃时反应达到平衡,甲基环氧乙烷选择性为80%,此时容器体积为2L。
提示:甲基环氧乙烷选择性等于甲基环氧乙烷的物质的量与甲基环氧乙烷和丙醛总物质的量之比。
主反应的平衡常数K=。保持温度、容积不变,再充入0.5mol和0.5mol , 副反应(填“向正反应方向”、“向逆反应方向”或“不”)进行。
11. 元素周期表中第VIIA族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。卤素及其化合物在生产生活中的应用非常广泛。回答下列问题:(1)、氯原子的核外电子排布式为。(2)、为了延长液氯的杀菌时间,某些自来水厂在用液氯进行消毒处理时还加入了液氨,其反应的化学方程式为NH3+HClO=H2O+NH2Cl,其中N、O、H的电负性由小到大的顺序为(用元素符号表示);HClO中氧原子的杂化方式为:NH3分子的VSEPR模型为;在水和苯两种溶剂中,NH2Cl更易溶于。(3)、卤素单质的化学键的键参数如表所示:化学键
F-F
Cl-Cl
Br-Br
I-I
键长/pm
141
198
228
267
键能/(kJ·mol-1)
157
242.7
193.7
152.7
从物质结构角度分析,F—F键的键能反常的原因是。
(4)、AgCl的晶胞与NaCl的类似,AgCl的晶胞结构如图所示,已知晶胞边长为 a pm,则晶胞内Ag+的配位数为 , 晶胞的6个面心围成的正八面体的边长为pm,设阿伏加德罗常数的值为NA , 则该晶体的密度为(列出计算表达式)g·cm-3。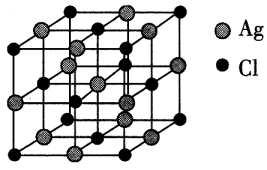 12. 有机物K与天然生物碱的结构类似,具有抗组胺活性,可用于减轻皮肤瘙痒感。该有机物的一种合成路线如图。
12. 有机物K与天然生物碱的结构类似,具有抗组胺活性,可用于减轻皮肤瘙痒感。该有机物的一种合成路线如图。
回答下列问题:
(1)、E的名称是。(2)、H中含有官能团的名称为;H→I在流程中的作用是。(3)、写出A→B的化学方程式: , 该反应的反应类型为。(4)、芳香族化合物M与I互为同分异构体,则分子中含-NO2的M的结构有种;其中核磁共振氢谱吸收峰面积之比为6:2:1的结构简式为。(5)、根据已有知识并结合相关信息,设计以1,3-丁二烯为原料制备 的路线流程图(无机试剂任用)。
的路线流程图(无机试剂任用)。