安徽省江淮名校2022届高三下学期5月联考理科综合化学试题
试卷更新日期:2022-07-08 类型:高考模拟
一、单选题
-
1. 航天员翟志刚、王亚平、叶光富首次完成“天和”核心舱在轨6个月的任务后,于2022年4月16日乘坐神舟十三号载人飞船返回地球,标志着我国载人航天工程处于世界前列。下列有关说法正确的是( )A、核心舱采用的氮化硼陶瓷属于新型无机非金属材料 B、核心舱采用的柔性太阳能电池翼可将光能转化为化学能 C、核心舱采用的镁合金具有在高温潮湿环境下耐腐蚀的化学特性 D、核心舱采用无水氢氧化锂净化二氧化碳的反应属于化合反应2. 某有机合成中间体P的结构简式如图所示。有关化合物P的叙述正确的是( )
 A、分子式为C5H10O4 B、1molP最多加成2molH2 C、有氧化性 D、1molP水解最多消耗2molNaOH3. 下列有关实验操作的示意图有错误的是( )
A、分子式为C5H10O4 B、1molP最多加成2molH2 C、有氧化性 D、1molP水解最多消耗2molNaOH3. 下列有关实验操作的示意图有错误的是( ) A、图甲是蒸发NaCl溶液 B、图乙是取大理石 C、图丙是向无氧环境加水样 D、图丁是分离CCl4与水4. 某物质在水溶液中得到了如图所示的结构,虚线表示氢键,其中X、Y、Z和M是原子序数依次增大的短周期元素。下列说法错误的是( )
A、图甲是蒸发NaCl溶液 B、图乙是取大理石 C、图丙是向无氧环境加水样 D、图丁是分离CCl4与水4. 某物质在水溶液中得到了如图所示的结构,虚线表示氢键,其中X、Y、Z和M是原子序数依次增大的短周期元素。下列说法错误的是( )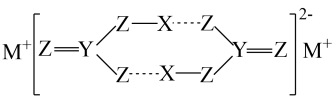 A、非金属性: Z>Y B、该结构中Z均满足8电子稳定结构 C、M的焰色试验呈黄色 D、氢键的存在使该物质在水中的溶解性较大5. 下列反应的离子方程式正确的是( )A、向Ba(OH)2溶液中加入稀硫酸: OH-+ H+= H2O B、向AgCl浊液中加入少量Na2S溶液: 2AgCl+S2- = 2Ag+S+ 2Cl- C、向NH4Cl溶液中加入镁粉: Mg + 2 = Mg2++ 2NH3↑+ H2↑ D、向NaOH水溶液中加入溴乙烷并加热: C2H5Br + NaOHC2H4↑+ NaBr+ H2O6. 科研工作者利用磷盐a、b实现了电化学合成氨,是人工固氮的一种新方式,其工作原理如图所示。下列说法正确的是( )
A、非金属性: Z>Y B、该结构中Z均满足8电子稳定结构 C、M的焰色试验呈黄色 D、氢键的存在使该物质在水中的溶解性较大5. 下列反应的离子方程式正确的是( )A、向Ba(OH)2溶液中加入稀硫酸: OH-+ H+= H2O B、向AgCl浊液中加入少量Na2S溶液: 2AgCl+S2- = 2Ag+S+ 2Cl- C、向NH4Cl溶液中加入镁粉: Mg + 2 = Mg2++ 2NH3↑+ H2↑ D、向NaOH水溶液中加入溴乙烷并加热: C2H5Br + NaOHC2H4↑+ NaBr+ H2O6. 科研工作者利用磷盐a、b实现了电化学合成氨,是人工固氮的一种新方式,其工作原理如图所示。下列说法正确的是( ) A、X为阴极,其电极反应式为H2- 2e- =2H+ B、过程②的反应主要有Li3N+3H2O=3LiOH+NH3 C、当外电路转移3mole时,理论上产生22.4LNH3 ( 标准状况) D、由图示过程可知,磷盐a被还原,磷盐b被氧化7. 氨法脱去烟气中的CO2在某些化学工程应用方面优势显著。将NH3负载的CO2气流通入水中,得到的NH3-CO2-H2O体系中有关物种的物质的量变化(Δn1)如图所示。
A、X为阴极,其电极反应式为H2- 2e- =2H+ B、过程②的反应主要有Li3N+3H2O=3LiOH+NH3 C、当外电路转移3mole时,理论上产生22.4LNH3 ( 标准状况) D、由图示过程可知,磷盐a被还原,磷盐b被氧化7. 氨法脱去烟气中的CO2在某些化学工程应用方面优势显著。将NH3负载的CO2气流通入水中,得到的NH3-CO2-H2O体系中有关物种的物质的量变化(Δn1)如图所示。
下列说法错误的是( )
A、CO2被氨水吸附的主要反应CO2+ NH3+ H2O=+ B、CO2负载量为0.2,则溶液中c( )+c(NH3)=5c( )+5c( )+5c(H2CO3) C、若烟气中混有SO2 , 则CO2的吸附量会下降 D、提高CO2负载量,CO2的吸附量会降低二、综合题
-
8. 废旧锂离子电池阴极材料回收再利用,在节约能源方面具有重要的意义。一种LiCoO2阴极材料回收再利用的工艺流程如图所示。

回答下列问题:
(1)、滤渣I的成分为Al、 CoO, “酸洗”的主要作用是。(2)、滤渣II的成分为LiCoO2、CoO,“酸浸”发生的氧化还原反应的化学方程式为。(3)、当金属阳离子浓度小于1.0 ×10-5 mol·L-1时沉淀完全,Al3+恰好 完全沉淀时,溶液的pH为; 反应Al3++3NH3·H2O Al(OH)3↓+3的平衡常数K。[已知: Kb (NH3·H2O) =2.0× 10-5 , lg5=0.7, 25℃时,Ksp[Al(OH)3]=5.0 × 10-33](4)、CoC2O4和Li2CO3可在空气氛围中焙烧重新得到LiCoO2 , 发生的总化学反应方程式为 ;一般要求LiCoO2杂质含量极低,检验LiCoO2中Na2CO3是否洗涤干净的方法是。9. 某小组从反应速率和产物角度探究Mg与NaHCO3溶液反应。实验I、25℃, 相同镁条分别与下列试剂反应
序号
试剂
浓度(mol·L-1)
体积(mL)
pH
现象
i
H2O
——
7.5
7
镁条表面有微量气泡附着
ii
NaHCO3溶液
1.0
7.5
8.4
镁条表面持续产生大量气泡,溶液略显浑浊,点燃气泡有爆鸣声
(1)、已知: Mg(OH)2固体致密,易包裹在金属表面成膜。根据上述现象,推测在实验ii中。①Mg可以提高的电离程度,原因是;
②浑浊的主要原因是产生了(填化学式) ;
③实验ii中产生气泡的速率快于实验i的原因可能是。
(2)、补充实验II,证实(1)的推测:序号
试剂
浓度(mol·L-1)
体积(mL)
pH
现象
iii
NaNO3溶液
1.0
7.5
7
镁条表面有微量气泡附着
iv
Na2CO3溶液
0.5
7.5
11.8
持续产生少量气泡,溶液显浑浊
①小组设计实验iii 的目的是 ; 甲同学结合实验iv的现象认为可以不必进行实验iii,他的理由是;
②实验ii生成气体的速率快于实验iv,原因可能是 ;
③查资料知+Mg2+ [Mg(HCO3)]+ , 请从平衡移动的角度解释实验ii产生气体速率更快的原因。
10. CH4、CH3OH是重要的含碳燃料,将CH4设计成零碳排放的燃料电池,原理如图。CH4在电池中除电极反应外还发生的如下重整反应,其反应速率远大于电极反应速率。
①CH4(g)+ H2O(g)→CO(g) + 3H2(g) ΔH1= + 206.2 kJ/mol
②CH4(g) + CO2(g)→2CO(g) + 2H2(g) ΔH2= + 247.3 kJ/mol
(1)、负极反应式为CH4- 8e-+ 4O2- =CO2+ 2H2O、、。(2)、可循环使用的含碳物质有(写化学式)。(3)、CO与H2O(g)反应可制得H2 , 同时产生一种温室效应气体,其热化学方程式为。(4)、甲醇制氢的反应历程如图所示(*表示该物种吸附在固体催化剂表面),决定该过程总反应速率的步骤是(填标号)。a.碳氢键的断裂 b.氢氧键的断裂 c.碳氧键的形成
 (5)、在上述甲醇制氢的反应历程中,如果OH*参与CH3OH*→CH3O*步骤,则该步骤的历程如图所示,
(5)、在上述甲醇制氢的反应历程中,如果OH*参与CH3OH*→CH3O*步骤,则该步骤的历程如图所示,
OH*起到的作用是。
(6)、关于甲醇制氢反应CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH> 0,既可以加快反应速率,又可以提高H2平衡产率的措施有____(填标号) 。A、升高温度 B、加入催化剂 C、增大H2O(g)浓度 D、增大压强(7)、CH2O*+ * CH2O*+ H*,正反应速率v1= k1c(CH2O*)c(*),逆反应速率v2= k1c(CHO*)c(H*),若K≥105反应进行完全,已知k1=2.5×109 , k-1= 8.4×103 , 判断正反应(填“进行完全”或“未进行完全”)11. Cu是一种重要的金属元素,许多铜的化合物在医药、工农业生产中有重要作用。回答下列问题:(1)、基态Cu原子的价电子排布式为;比较Cu2+和Zn2+稳定性并分析原因:。(2)、一种铜的配合物结构如图1所示,其对肿瘤有明显的抑制作用,该配合物中几种非金属元素的电负性由大到小的顺序为 , 配位原子的杂化方式为。 (3)、金属铜单独与氨水或过双氧水都不反应,但可与氨气和双氧水的混合溶液反应,其原因。(4)、NH3分子中H-N-H键角为107° ,在[Cu(NH3)4]2+中的H-N-H键角为109.5° ,键角变大的原因是。(5)、Cu2O 晶体结构与CsCl (图2)相似,只是利用Cu4O占据CsCl晶体中Cl的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有个 “Cu2O”;Cu2O晶胞中Cu的配位数是;若①处Cu原子坐标为( , , ),则Cu2O晶胞中Cu4O四面体中O原子坐标为。
(3)、金属铜单独与氨水或过双氧水都不反应,但可与氨气和双氧水的混合溶液反应,其原因。(4)、NH3分子中H-N-H键角为107° ,在[Cu(NH3)4]2+中的H-N-H键角为109.5° ,键角变大的原因是。(5)、Cu2O 晶体结构与CsCl (图2)相似,只是利用Cu4O占据CsCl晶体中Cl的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有个 “Cu2O”;Cu2O晶胞中Cu的配位数是;若①处Cu原子坐标为( , , ),则Cu2O晶胞中Cu4O四面体中O原子坐标为。 12. 盐酸克林沙星是一种高效的抗菌消炎盐酸盐类药物( 盐酸盐的通式为R·HCl),其合成方法如下。
12. 盐酸克林沙星是一种高效的抗菌消炎盐酸盐类药物( 盐酸盐的通式为R·HCl),其合成方法如下。
已知: (1) R-CH3 R-COOH
(2) (R1、R2、R3和R4代表除H外的任意基团)
(R1、R2、R3和R4代表除H外的任意基团)回答下列问题:
(1)、 的化学名称为 , 其最多有个原子共平面。 (2)、C的分子式为C7H2ClFN2O5 , 则生成A的反应方程式为; B→C的反应类型为。(3)、已知E分子中有两个六元环,则E的结构简式为。(4)、
的化学名称为 , 其最多有个原子共平面。 (2)、C的分子式为C7H2ClFN2O5 , 则生成A的反应方程式为; B→C的反应类型为。(3)、已知E分子中有两个六元环,则E的结构简式为。(4)、 的水解产物为C2H5OH和;该产物具有
的水解产物为C2H5OH和;该产物具有 结构且苯环上有5个取代基的同分异构体有。种。 (5)、盐酸克林沙星服用过量会引发头晕等酸中毒现象,应及时就医,服用或注射主要成分为____的药物。(填写正确答案标号)A、NaOH B、BaCO3 C、BaSO4 D、NaHCO3
结构且苯环上有5个取代基的同分异构体有。种。 (5)、盐酸克林沙星服用过量会引发头晕等酸中毒现象,应及时就医,服用或注射主要成分为____的药物。(填写正确答案标号)A、NaOH B、BaCO3 C、BaSO4 D、NaHCO3